なぜ人々は水が生命に必要であると言うのですか?完全に乾燥した環境で繁殖できる生物を見つけたことがないのはなぜですか?無臭、無色、無味、そして比較的反応の少ないものが私たちの体重の60%を占めるのはどうしてですか?なぜ別の液体を使用できないのですか?なぜ水なのか?
水には、化合物の中で独特であり、あらゆる形態の既知の生命が機能することを可能にするいくつかの特性があります。
水は、自然に発生する温度で3つの物理的状態すべてに見られる唯一の天然物質です。
これは、水を液体、川や海、固体、雪や氷、気体、雲や蒸気と見なすことを意味します。そうでない場合、水循環は完全に異なり(水が太陽の下で蒸発しなかった場合はどうなりますか?)、雪と氷が存在しない可能性があり(そして何千もの種が今や家を失います)、天気は非常に異なります(まだ雨が降っていますか?)他に何か違うことは考えられますか?水が地球上で自然に発生する温度で液体だけだったら、私たちはまだ生きていけると思いますか?ガス/固体だけはどうですか?
氷は水よりも密度が低い
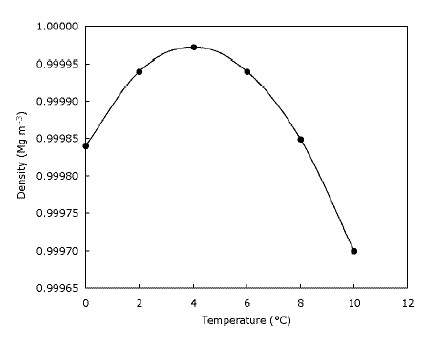
これは、氷が水に浮かび、湖が上から下に向かって凍結することを意味します。これは、生息地が大幅に減少するか存在しないため、氷の上に住む動物にとって明らかに重要です。同様に、湖や池が下から上に凍ると、魚や他の池の生活に影響が出ます。池の上部にある凍った水の層は、ある程度の断熱を提供し、残りの水が冷えるのを防ぎます。寒さの間に障壁を作ることによってこれを行います下の空気と水。これは、大きな水域が氷が沈んだ場合ほど速く冷えず、冬の間池で野生生物が生き残るのに役立つことを意味します。実際、水は$ 4 ^ \ circ $に達するまで冷却されると密度が高くなります。 C(グラフで確認できます)、その後再び密度が低くなります。ほとんどの物質は、冷却されるにつれて徐々に密度が高くなります。下のグラフは、水の密度が温度とともにどのように変化するかを示しています。
水は他の同様の分子と比較して非常に高い融点と沸点を持っています
これは、地球上で固体、液体、気体と見なされることを意味します。水が私たちが地球上で見るほとんどの温度で液体は海がすべて氷であり、雨がなく、植物が集めたり動物が飲んだりすることはありません。私たちの細胞でさえ液体の水で満たされているので、それも不可能です。
非常に多くの物質を溶解できるため、「ユニバーサルソルベント」と呼ばれています。
私たちの体内の水i sは主に私たちの細胞に含まれており、細胞に明確な形を与えるだけでなく、何十億もの有用な分子が細胞に溶解しています。細胞内の酵素は溶液中でのみ機能するため、細胞を適切に機能させるには、細胞を水で満たす必要があります。水は私たちの体で輸送が起こる手段でもあります」血液は主に水であり、ホルモンやガスが最初に溶解し、尿素などの毒素がさらに多くの水で体から除去されます。水中での輸送ははるかに小さいスケール:何かが溶解すると、それは溶媒中で動き回ることができます。たとえば、酵素がカルシウムイオンを活性化して働き始める必要がある場合、細胞内の溶液中で動き回るときにこれらに会います。濃度が高いほど細胞内のカルシウムが多いほど、酵素がより早くイオンに出会う可能性が高くなります。また、細胞がどのように機能し、水の存在に依存するかを理解する上で重要な概念である拡散と浸透についても学んだかもしれません。
水は高い特異性を持っています熱容量。
このアイデアは少し怖いように聞こえますが、実際には非常に単純です。つまり、水を少し暖かくするには多くのエネルギーが必要です。これが、暑い日にビーチの砂ができる理由です。暑すぎて歩けないでも海はまだ涼しいです。太陽からのエネルギーは砂をたくさん加熱するのに十分ですが、水はほんの少しです。これは、特に水中に生息する生物にとって、いくつかの非常に重要な意味を持っています。海、湖、川は空気よりもはるかに一定の温度を維持します。つまり、動物は大きな温度変化に適応することなく、一年中水中で生活できます(水がより簡単に冷えるとどうなると思いますか?これはどのような問題でしょうか?小さな池に住む生物にポーズをとる?)これはまた、私たちの体温をすばやく変えるのがかなり難しいことを意味し、したがって、一定の体温を維持するという脳の仕事がはるかに簡単になります(私たちの体温がすばやく簡単に変わるとどうなるでしょうか?)
表面張力
水を入れたボウルの表面に針を置くと浮きますが、針を投げると沈むことに気づいたかもしれません。これは、針が水よりも密度が高いため、沈みたいのですが、水の表面張力によって支えられているためです。表面張力は、水面が壊れたくないことを意味する特性です-それは「粘着性」です。水面が一緒に保持され、こぼれにくいので、つばにカップを満たしたときにもこれを見ることができます。水の表面張力が高いため、一部のハエは沈むことなく水面に着地することができます。この概念は、別の毛細管現象の概念とも非常に密接に関連しています。
毛細管現象
表面張力と同様に、これは水の分子が「くっつく」という考えを中心に展開します。非常に細いチューブを水のビーカーに入れると、水の一部がチューブを少し上って移動することがわかります。これは毛細管現象と呼ばれ、水がチューブの側面や他の水分子に付着し、一緒にチューブを引き上げることによって引き起こされます。最終的に、引っ張られる水の重量は支えられないほど大きくなり、水は平衡に達して動きを停止します。これと同じ原理により、植物は地面から水を汲み上げることができます。水分子が茎を上って移動するにつれて、水柱が木部で輸送されるまで、より多くの水分子がそれらに付着し、より多くの水分子が付着します(これについて詳しくは、「蒸散」を調べてください)。
しかし、なぜですか?
私たちが知っているように、水のこれらの特性はすべて生命にとって重要ですが、なぜ水にそれらがあるのですか?他の物質もこれらのことをしませんか?それを変えるのは水について何ですか?これらの質問に対する答えを理解するには、水の分子構造を研究する必要があります。水の化学式はH2Oです。つまり、次のように1つの酸素原子に共有結合した2つの水素原子が含まれています。
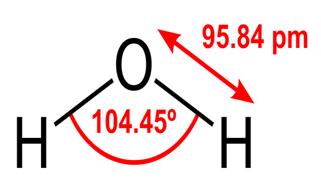
95.84pmは、酸素と水素の間の結合;午後1時は、1兆分の1メートルであるピコメートルの略です。示されている角度は、2つの水素原子核間の鋭角です(なぜ$ 180 ^ \ circ $でないのか、なぜ$ 180 ^ \ circ $なのかについて何か考えがありますか?)この図は、結合を線として表しています。酸素は水素よりも電気陰性度が高いため、OH結合内の電子をそれ自体に引き付けます。線の太さが電子密度(電子の時間)を表す場合は、すべての点で同じように見えます。結合のその部分で費やす)、OH結合は実際には次のようになります:
結合の分極を示す図
ご覧のとおり、電子はほとんどの時間を酸素原子核の近くで過ごします。これは、酸素はわずかに負に帯電し、水素はわずかに正に帯電します。これは極性と呼ばれ、水の特性の背後にある重要な概念です
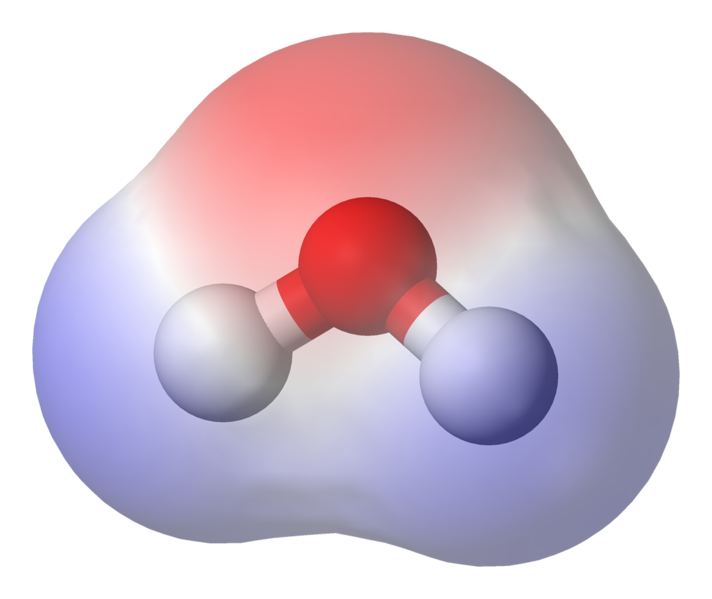
これは、n間で弱いイオン相互作用が発生する可能性があることを意味しますある分子からのわずかに正の水素が別の分子のわずかに負の酸素に引き付けられるので、水分子を隣接させます。これらは水素結合と呼ばれます。
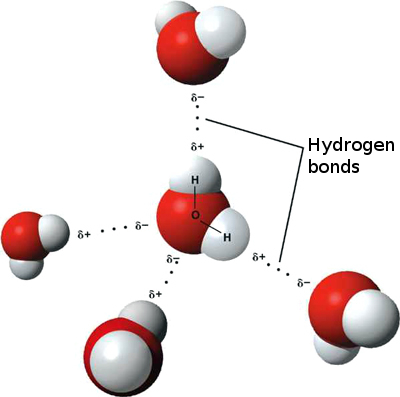
これが水がそれ自体に「付着」し、高い表面張力と毛細管現象によって移動する能力を与える理由です。
水素結合を分解するには大量のエネルギーが必要です。そのため、水の融点と沸点が高く、比熱容量が高いのです。
物質が極性または極性の場合、水に溶解します。イオン性。これは、水と水素結合を形成して溶解するためです。油は極性がないため、溶解しません。塩、NaClはイオン性であるため溶解します。水に溶ける他の物質について考えられますか?彼らはどのようにそれと水素結合を形成しますか?なぜグルコースが溶けるのかを示す下の絵と同じような絵を描くことができますか?それは塩よりも多かれ少なかれ水に溶けますか?これはなぜだと思いますか?
溶液中のNaClに何が起こるかの図:
