Hvorfor siger folk, at vand er nødvendigt for livet? Hvorfor har vi aldrig fundet nogen levende organisme, der kan blomstre i et helt tørt miljø? Hvordan er det, at noget lugtfrit, farveløst, smagløst og relativt ureaktivt udgør 60% af vores kropsmasse? Hvorfor kunne en anden væske ikke bruges? Hvorfor vand?
Vand har flere egenskaber, der gør det unikt blandt forbindelser og gør det muligt for alle former for kendt liv at fungere.
Det er det eneste naturlige stof, der findes i alle tre fysiske tilstande ved de temperaturer, der naturligt forekommer på Jorden.
Dette betyder, at vi ser vand som en væske i floder og have, et fast stof, som sne og is og som en gas, som skyer eller damp. Hvis dette ikke var tilfældet, ville vandcyklussen være helt anderledes (hvad hvis vand ikke fordampede i solen?); Sne og is eksisterede muligvis ikke (og tusinder af arter ville nu være hjemløse) og vejret ville være meget anderledes ( ville det stadig regne?). Kan du tænke på alt andet, der ville være anderledes? Tror du, at vi stadig kunne leve, hvis vand kun var en væske ved de temperaturer, der forekommer naturligt på Jorden? Hvad med kun en gas / fast stof?
Is er mindre tæt end vand
Dette betyder bare, at is flyder på vand, og at søer fryser fra top og ned til bunden. Dette er helt klart vigtigt for dyr, der lever på is, da deres levesteder ville blive kraftigt reduceret eller ikke eksisterer Overhovedet hvis isen sank. På samme måde ville fisk og andet dam-liv blive påvirket, hvis søer og damme frøs nedefra og op – laget frossent vand øverst i dammen giver en vis isolering og forhindrer resten af vandet i at blive koldt Det gør det ved at skabe en barriere mellem kulden luft og vandet under. Dette betyder, at store vandmasser ikke bliver kolde dybere nede så hurtigt som de kunne, hvis isen sank og hjælper dyrelivet med at overleve i damme over vinteren. Faktisk bliver vandet tættere, når det afkøles, indtil det når $ 4 ^ \ circ $ C (som du kan se på grafen), hvorefter det bliver mindre tæt igen. De fleste stoffer bliver gradvis mere tætte, efterhånden som de afkøles. Grafen nedenfor viser, hvordan vandtætheden ændres med temperaturen.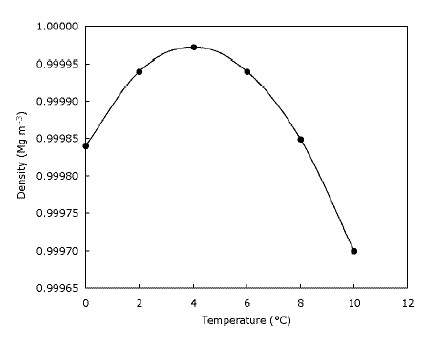
Vand har et meget højt smelte- og kogepunkt sammenlignet med andre lignende molekyler
Dette er, hvad der betyder, at det ses som et fast stof, en væske og en gas på Jorden. Hvis vand ikke var et væske ved de fleste af de temperaturer, vi ser på Jorden, ville havene alle være is, der ville ikke være regn, intet for planter at samle og dyr at drikke. Selv vores celler er fyldt med flydende vand, hvilket heller ikke ville være muligt.
Det kaldes det “universelle opløsningsmiddel”, fordi det er i stand til at opløse så mange stoffer.
Vandet i vores kroppe i De er for det meste indeholdt i vores celler, hvor det giver dem en klar form samt at have milliarder af nyttige molekyler opløst i den. Vores celler skal fyldes med vand for at fungere ordentligt, fordi enzymerne i dem kun fungerer i opløsning. Vand er også det middel, hvormed transport finder sted i vores kroppe “blod er for det meste vand og har hormoner og gasser opløst init samt toksiner såsom urinstof, som fjernes fra kroppen med endnu mere vand. Transport i vand forekommer også på en meget mindre skala: når noget er opløst, kan det bevæge sig rundt i opløsningsmidlet. Hvis et enzym f.eks. har brug for calciumioner for at blive aktiveret og begynder at arbejde, vil det opfylde disse, når de bevæger sig rundt i opløsningen inde i en celle. Jo højere koncentration af calcium i cellen, jo mere sandsynligt vil enzymet møde en ion hurtigere. Du har muligvis også lært om diffusion og osmose, som er nøglekoncepter for at forstå, hvordan celler fungerer og stole på tilstedeværelsen af vand
Vand har en høj specifik varmekapacitet.
Selvom denne idé lyder en smule skræmmende, er den faktisk meget enkel – alt hvad det betyder er, at det tager meget energi at gøre vandet lidt varmere. Derfor er sandet på en strand på en varm dag kan være for varmt til at gå på, men havet føles stadig køligt; solenergiens energi er nok til at opvarme sandet meget, men vandet kun lidt. Dette har nogle meget vigtige konsekvenser, især for organismer, der lever i vand. Hav, søer og floder opretholder en meget mere konstant temperatur end luft, hvilket betyder, at dyr kan leve i vand året rundt uden at skulle tilpasse sig store temperaturændringer (Hvad tror du ville ske, hvis vandet afkøles lettere? Hvilke problemer kan dette udgør for organismer, der lever i en lille dam?). Dette betyder også, at vores kropstemperatur med rimelighed er vanskelig at ændre sig hurtigt og dermed gør vores hjernes opgave med at opretholde en konstant kropstemperatur meget lettere (Hvad kan der ske, hvis vores kropstemperatur ændres hurtigt og nemt?).
Overfladespænding
Du har måske bemærket, at hvis du lægger en nål på overfladen af en skål vand, flyder den, men hvis du smider den i, synker den.Dette skyldes, at nålen er tættere end vand så ønsker at synke, men holdes op af vandets overfladespænding. Overfladespænding er en egenskab, der betyder, at overfladen af vand ikke vil bryde – den er “klæbrig”. Du kan også se dette, når du fylder en kop til randen, da vandets overflade holder sammen og modstår spild. Den høje overfladespænding af vand er grunden til, at nogle fluer kan lande på overfladen uden at synke. Dette koncept er også meget tæt forbundet med et andet, ideen om kapillær handling.
Kapillær handling
På samme måde som overfladespænding drejer dette sig om ideen om, at vandmolekyler “klæber” sammen. Hvis du lægger et meget fint rør i et bægerglas med vand, vil du se, at noget af vandet bevæger sig en kort vej op ad røret; dette kaldes kapillær handling og skyldes, at vandet klæber sig fast til rørets sider og til andre vandmolekyler, der trækker dem op med røret. Til sidst er vægten af vandet, der trækkes, for stor til at understøttes, og vandet holder op med at bevæge sig efter at have nået en ligevægt. Det samme princip tillader planter at trække vand op fra jorden; når vandmolekyler bevæger sig op ad stammen, holder flere vandmolekyler sig til dem og mere holder sig til dem og så videre, indtil en søjle vand transporteres i xylemet (for at finde ud af mere om dette, se “transpiration”).
Men hvorfor?
Alle disse egenskaber ved vand er kritiske for livet, som vi kender det, men hvorfor har vand dem? Gør intet andet stof også disse ting? Hvad er det ved vand, der gør det anderledes? For at forstå svarene på disse spørgsmål skal du studere vandets molekylære struktur. Den kemiske formel for vand er H2O, hvilket betyder, at det indeholder to hydrogenatomer kovalent bundet til etoxygenatom, som dette: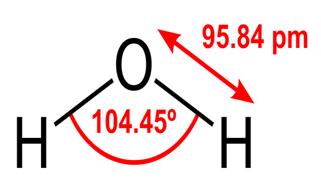
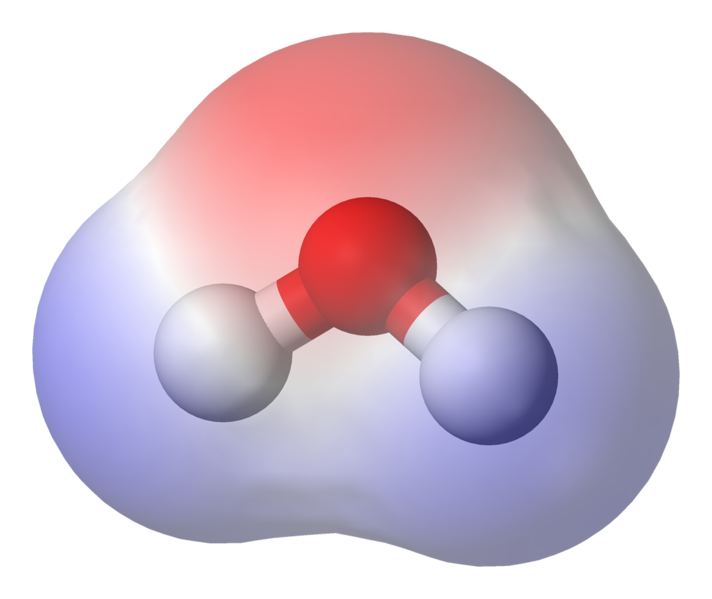
95.84pm viser længden af binding mellem ilt og brint; en pm er en forkortelse for et picometre, som er en billiontedel af en meter. Den viste vinkel er den spidse vinkel mellem de to brintkerner (har du nogen ideer om, hvorfor det ikke er $ 180 ^ \ circ $? Hvorfor skal det være $ 180 ^ \ circ $?) Dette diagram repræsenterer bindingerne som linjer, som får det til at se ud som om de er de samme på evigt punkt? Dette er ikke tilfældet. Da ilt er mere elektronegativt end brint, tiltrækker det elektronerne i OH-bindingen mod sig selv. Hvis linjens tykkelse repræsenterer elektrondensitet (mængden af tid elektroner bruge i den del af båndet), ser OH-båndet faktisk mere sådan ud:
BILLEDE, der viser polarisering af binding
Som du kan se, bruger elektronerne det meste af deres tid nærmere iltkernen. Dette betyder, at ilt er lidt negativt ladet, og at hydrogenerne er lidt positivt ladede. Dette kaldes polaritet og er nøglebegrebet bag vandets egenskaber
Dette betyder, at svage ioniske interaktioner kan forekomme mellem n ved siden af vandmolekyler som det lidt positive brint fra et molekyle tiltrækkes af det lidt negative ilt på et andet. Disse kaldes hydrogenbindinger.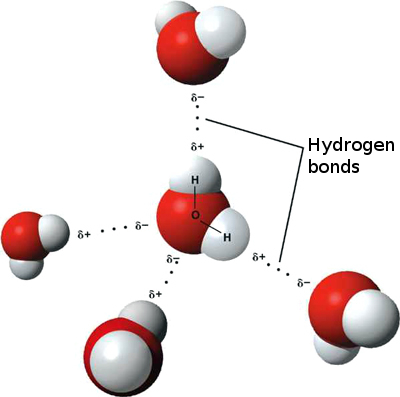
Dette er grunden til, at vand “klæber” til sig selv, hvilket giver det høj overfladespænding og evnen til at bevæge sig ved kapillær handling.
Der kræves en hel del energi til at nedbryde hydrogenbindingerne, hvorfor vandets smelte- og kogepunkter er høje, og hvorfor det har en høj specifik varmekapacitet
Et stof opløses i vand, hvis det er polært eller ionisk. Dette skyldes, at det opløses ved at danne hydrogenbindinger med vandet. Olie er ikke polær, hvorfor det ikke opløses. Salt, NaCl, opløses, fordi det er ionisk. Kan du tænke på nogle andre stoffer, der er opløselige i vand? Hvordan danner de hydrogenbindinger med det? Kan du tegne et lignende billede som det nedenfor, der viser, hvorfor glukose er opløselig? Er det mere eller mindre opløseligt i vand end salt? Hvorfor tror du dette er?
Et diagram over, hvad der sker med NaCl i løsning:
