Varför säger folk att vatten är nödvändigt för livet? Varför har vi aldrig hittat någon levande organism som kan blomstra i en helt torr miljö? Hur är det att något luktfritt, färglöst, smaklöst och relativt oreaktivt utgör 60% av vår kroppsmassa? Varför kunde en annan vätska inte användas? Varför vatten?
Vatten har flera egenskaper som gör det unikt bland föreningar och gör det möjligt för alla former av känt liv att fungera.
Det är det enda naturliga ämnet som finns i alla tre fysiska tillstånden vid de temperaturer som naturligt förekommer. på jorden.
Detta betyder att vi ser vatten som en vätska, i floder och hav, ett fast ämne, som snö och is och som en gas, som moln eller ånga. Om detta inte var fallet skulle vattencykeln vara helt annorlunda (tänk om vatten inte avdunstade i solen?), Snö och is kanske inte existerade (och tusentals arter skulle nu vara hemlösa) och vädret skulle vara mycket annorlunda ( skulle det fortfarande regna?). Kan du tänka dig något annat som skulle vara annorlunda? Tror du att vi fortfarande skulle kunna leva om vatten bara var en vätska vid de temperaturer som förekommer naturligt på jorden? Vad sägs om bara en gas / fast substans?
Is är mindre tät än vatten
Detta betyder bara att is flyter på vatten och att sjöar fryser uppifrån och ner till botten. Detta är helt klart viktigt för djur som lever på is, eftersom deras livsmiljöer skulle minska kraftigt eller inte alls om isen sjönk. På samma sätt skulle fisk och annat dammliv påverkas om sjöar och dammar frös nedifrån och upp – skiktet av fryst vatten på toppen av dammen ger en viss isolering och förhindrar att resten av vattnet blir kallt Det gör det genom att skapa en barriär mellan kylan luft och vattnet nedanför. Detta innebär att stora vattendrag inte blir kalla djupare ner så fort de kan om isen sjönk och hjälper vilda djur att överleva i dammar över vintern. I själva verket blir vattnet tätare när det kyls tills det når $ 4 ^ \ circ $ C (som du kan se på bilden), varefter den blir mindre tät igen. De flesta ämnen blir gradvis tätare när de kyls. Grafen nedan visar hur vattentätheten förändras med temperaturen.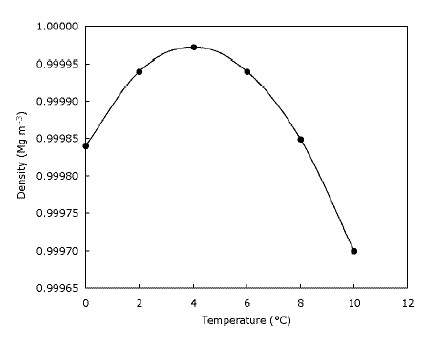
Vatten har en mycket hög smält- och kokpunkt jämfört med andra liknande molekyler. Detta är vad som betyder att det ses som ett fast ämne, en vätska och en gas på jorden. Om vatten inte var ett vätska vid de flesta temperaturer som vi ser på jorden, havet skulle alla vara is, det skulle inte finnas något regn, inget för växter att samla och djur att dricka. Även våra celler är fyllda med flytande vatten, vilket inte heller skulle vara möjligt.
Det kallas ”universellt lösningsmedel” eftersom det kan lösa så många ämnen.
Vattnet i våra kroppar i Det finns mestadels i våra celler, där det ger dem en tydlig form och har miljarder användbara molekyler upplösta i sig. Våra celler måste fyllas med vatten för att fungera ordentligt eftersom enzymerna i dem bara fungerar i lösning. Vatten är också det sätt på vilket transport sker i våra kroppar ”blod är mestadels vatten och har hormoner och gaser upplösta initialt samt toxiner såsom urea, som avlägsnas från kroppen med ännu mer vatten. Transport i vatten sker också på en mycket mindre skala: när något är upplöst kan det röra sig i lösningsmedlet. Om ett enzym till exempel behöver kalciumjoner för att aktiveras och börja arbeta kommer det att möta dessa när de rör sig i lösningen inuti en cell. Ju högre koncentration desto mer sannolikt kommer enzymet att möta en jon tidigare. Du kan också ha lärt dig om diffusion och osmos, som är nyckelbegrepp för att förstå hur celler fungerar och förlita sig på närvaron av vatten. Vatten har en hög specifik värmekapacitet.
Även om denna idé låter lite skrämmande är den faktiskt väldigt enkel – allt det betyder är att det tar mycket energi att göra vattnet lite varmare. Det är därför en sand på en varm dag kan vara för varmt för att gå på men havet känns fortfarande coolt; solenergin räcker för att värma upp sanden mycket men vattnet bara lite. Detta har några mycket viktiga konsekvenser, särskilt för organismer som lever i vatten. Hav, sjöar och floder håller en mycket mer konstant temperatur än luft, vilket innebär att djur kan leva i vatten året runt utan att behöva anpassa sig till stora temperaturförändringar (Vad tror du skulle hända om vattnet svalnar lättare? Vilka problem kan detta utgör för organismer som bor i en liten damm?). Detta innebär också att vår kroppstemperatur är ganska svår att förändra snabbt och därmed gör hjärnans jobb att hålla en konstant kroppstemperatur mycket lättare (Vad kan hända om vår kroppstemperatur ändras snabbt och enkelt?).
Ytspänning
Du kanske har lagt märke till att om du lägger en nål på ytan av en skål med vatten flyter den, men om du kastar den i den sjunker den.Detta beror på att nålen är tätare än vatten så vill sjunka men hålls upp av vattens ytspänning. Ytspänning är en egenskap som betyder att vattenytan inte vill gå sönder – den är ”klibbig”. Du kan också se detta när du fyller en kopp till kanten, eftersom vattenytan kommer att hålla ihop och motstå spill. Vattens höga ytspänning är anledningen till att vissa flugor kan landa på ytan utan att sjunka. Detta koncept är också mycket nära besläktat med en annan, tanken på kapillärverkan.
Kapillärverkan
På samma sätt som ytspänningen kretsar detta kring idén att molekyler av vatten ”hänger samman”. Om du lägger ett mycket fint rör i en bägare med vatten ser du att en del av vattnet färdas en kort väg upp röret; detta kallas kapillärverkan och orsakas av att vattnet klamrar sig fast vid rörets sidor och andra vattenmolekyler och drar upp dem med röret. Så småningom är vikten av vattnet som dras för stor för att stödjas och vattnet slutar röra sig efter att ha nått en jämvikt. Samma princip gör det möjligt för växter att hämta vatten från marken; när vattenmolekyler färdas upp på stammen, mer vattenmolekyler fäster vid dem och mer fäster vid dem och så vidare tills en kolonn med vatten transporteras i xylemen (för att ta reda på mer om detta, leta upp ”transpiration”).
Men varför?
Alla dessa egenskaper hos vatten är kritiska för livet så som vi känner det, men varför har vatten dem? Gör inget annat ämne också dessa saker? Vad är det med vatten som gör det annorlunda? För att förstå svaren på dessa frågor måste du studera vattnets molekylära struktur. Den kemiska formeln för vatten är H2O, vilket innebär att den innehåller två väteatomer kovalent bundna till enoxygenatom, så här: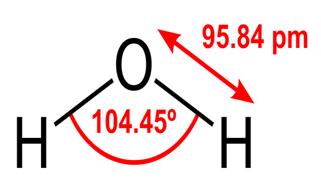
95.84 pm visar längden på bindning mellan syret och väte; en pm är en förkortning för en picometre, som är en biljondel meter. Vinkeln som visas är den spetsiga vinkeln mellan de två vätekärnorna (har du några idéer om varför det inte är $ 180 ^ \ circ $? Varför ska det vara $ 180 ^ \ circ $?) Detta diagram representerar bindningarna som linjer, vilka får det att se ut som om de är desamma vid varje punkt? Detta är inte fallet. Eftersom syre är mer elektronegativt än väte drar det till sig elektronerna i OH-bindningen mot sig själv. Om linjens tjocklek representerar elektrondensitet (den tid elektroner spendera i den delen av bindningen), OH-bindningen ser faktiskt mer ut så här:
BILD som visar polarisering av bindningen
Som du kan se att elektronerna tillbringar större delen av sin tid närmare syrekärnan. syre är något negativt laddat och att vätena är något positivt laddade. Detta kallas polaritet och är nyckelbegreppet bakom egenskaperna hos vatten
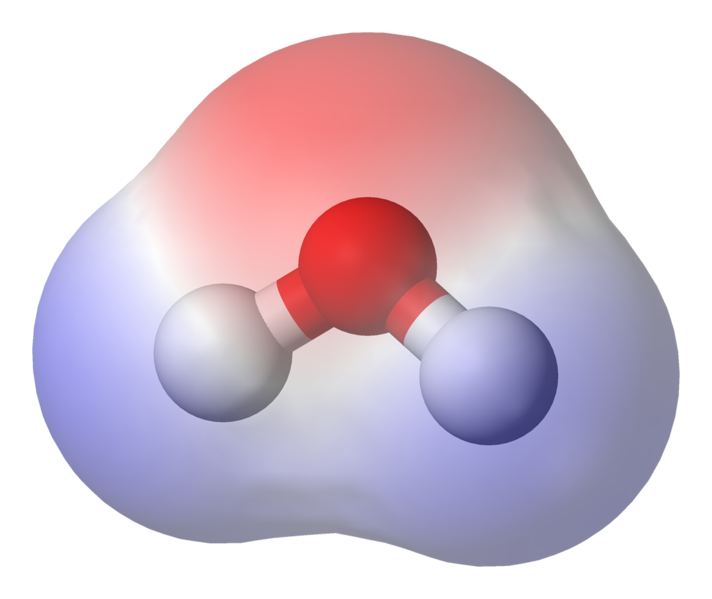
Detta innebär att svaga joninteraktioner kan uppstå mellan n närliggande vattenmolekyler som det något positiva vätet från en molekyl lockas till det lite negativa syret på en annan. Dessa kallas vätebindningar.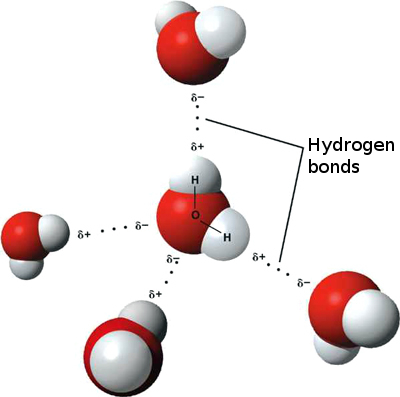
Det är därför vatten ”fastnar” vid sig själv, vilket ger hög ytspänning och förmågan att röra sig genom kapillärverkan.
Mycket energi krävs för att bryta ner vätebindningarna, varför smält- och kokpunkterna för vatten är höga och varför det har en hög specifik värmekapacitet
Ett ämne löses upp i vatten om det är polärt eller jonisk. Detta beror på att det löses upp genom att bilda vätebindningar med vattnet. Olja är inte polär, varför den inte kommer att lösas upp. Salt, NaCl, löses upp eftersom det är joniskt. Kan du tänka på några andra ämnen som är lösliga i vatten? Hur bildar de vätebindningar med det? Kan du rita en liknande bild som den nedan som visar varför glukos är löslig? Är det mer eller mindre lösligt i vatten än salt? Varför tror du att detta är?
Ett diagram över vad som händer med NaCl i lösning:
