Warum sagen die Leute, dass Wasser für das Leben notwendig ist? Warum haben wir nie einen lebenden Organismus gefunden, der in einer völlig trockenen Umgebung gedeihen kann? Wie kommt es, dass etwas Geruchs-, Farbloses, Geschmackloses und relativ Unreaktives 60% unserer Körpermasse ausmacht? Warum konnte keine andere Flüssigkeit verwendet werden? Warum Wasser?
Wasser hat mehrere Eigenschaften, die es unter den Verbindungen einzigartig machen und es allen Formen bekannten Lebens ermöglichen, zu funktionieren.
Es ist die einzige natürliche Substanz, die in allen drei physikalischen Zuständen bei den natürlich vorkommenden Temperaturen vorkommt auf der Erde.
Dies bedeutet, dass wir Wasser als Flüssigkeit, in Flüssen und Meeren, als Feststoff, als Schnee und Eis und als Gas, als Wolken oder Dampf sehen. Wenn dies nicht der Fall wäre, wäre der Wasserkreislauf völlig anders (was wäre, wenn das Wasser in der Sonne nicht verdunsten würde?), Schnee und Eis könnten nicht existieren (und Tausende von Arten wären jetzt obdachlos) und das Wetter wäre sehr unterschiedlich ( würde es noch regnen?) Können Sie sich noch etwas anderes vorstellen, das anders wäre? Glauben Sie, wir könnten noch leben, wenn Wasser bei den auf der Erde natürlich vorkommenden Temperaturen nur eine Flüssigkeit wäre? Was ist mit nur einem Gas / Feststoff?
Eis ist weniger dicht als Wasser
Dies bedeutet nur, dass Eis auf dem Wasser schwimmt und die Seen von oben nach unten gefrieren. Dies ist eindeutig wichtig für Tiere, die auf Eis leben, da ihre Lebensräume stark eingeschränkt wären oder nicht existieren würden überhaupt, wenn das Eis sank. Ebenso würden Fische und andere Teichleben beeinträchtigt, wenn Seen und Teiche von unten nach oben gefrieren würden – die Schicht aus gefrorenem Wasser oben auf dem Teich sorgt für eine gewisse Isolierung und verhindert, dass der Rest des Wassers kalt wird schnell, indem es eine Barriere zwischen der Kälte bildet Luft und Wasser unten. Dies bedeutet, dass große Gewässer nicht so schnell wie möglich kalt werden, wenn das Eis sinkt, und dass die Tierwelt im Winter in Teichen überlebt. Tatsächlich wird das Wasser dichter, wenn es abgekühlt wird, bis es 4 US-Dollar erreicht C (was Sie auf der Grafik sehen können), danach wird es wieder weniger dicht. Die meisten Substanzen werden beim Abkühlen zunehmend dichter. Die folgende Grafik zeigt, wie sich die Dichte des Wassers mit der Temperatur ändert.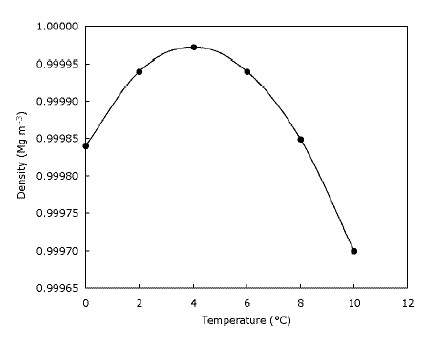
Wasser hat im Vergleich zu anderen ähnlichen Molekülen einen sehr hohen Schmelz- und Siedepunkt.
Dies bedeutet, dass es auf der Erde als Feststoff, Flüssigkeit und Gas angesehen wird. Wenn Wasser kein Wasser wäre Bei den meisten Temperaturen, die wir auf der Erde sehen, wären die Meere alle Eis, es würde keinen Regen geben, nichts, was Pflanzen sammeln und Tiere trinken könnten. Sogar unsere Zellen sind mit flüssigem Wasser gefüllt, was auch nicht möglich wäre br> Es wird das „universelle Lösungsmittel“ genannt, weil es in der Lage ist, so viele Substanzen aufzulösen.
Das Wasser in unserem Körper i Es ist hauptsächlich in unseren Zellen enthalten, wo es ihnen eine klare Form gibt und Milliarden nützlicher Moleküle darin gelöst sind. Unsere Zellen müssen mit Wasser gefüllt sein, damit sie richtig funktionieren, da die darin enthaltenen Enzyme nur in Lösung arbeiten. Wasser ist auch das Mittel, mit dem der Transport in unserem Körper stattfindet. „Blut besteht hauptsächlich aus Wasser und enthält Hormone und Gase, die in Init aufgelöst wurden, sowie Toxine wie Harnstoff, die mit noch mehr Wasser aus dem Körper entfernt werden. Der Transport im Wasser erfolgt auch auf einem viel kleinerer Maßstab: Wenn sich etwas aufgelöst hat, kann es sich im Lösungsmittel bewegen. Wenn beispielsweise ein Enzym Calciumionen benötigt, um aktiviert zu werden und zu arbeiten, werden diese erfüllt, wenn sie sich in der Lösung innerhalb einer Zelle bewegen. Je höher die Konzentration Je wahrscheinlicher das Enzym in der Zelle auf ein Ion trifft, desto wahrscheinlicher ist es, dass das Enzym früher auf ein Ion trifft. Möglicherweise haben Sie auch etwas über Diffusion und Osmose gelernt. Dies sind Schlüsselkonzepte für das Verständnis der Funktionsweise von Zellen und der Abhängigkeit von Wasser.
Wasser hat eine hohe Spezifität Wärmekapazität.
Obwohl diese Idee ein wenig einschüchternd klingt, ist sie eigentlich sehr einfach – alles, was es bedeutet, ist, dass viel Energie benötigt wird, um das Wasser ein bisschen wärmer zu machen. Deshalb an einem heißen Tag der Sand am Strand kann zu heiß zum laufen sein weiter, aber das Meer fühlt sich immer noch kühl an; Die Energie der Sonne reicht aus, um den Sand stark zu erhitzen, das Wasser jedoch nur wenig. Dies hat einige sehr wichtige Auswirkungen, insbesondere auf Organismen, die im Wasser leben. Meere, Seen und Flüsse haben eine viel konstantere Temperatur als Luft, was bedeutet, dass Tiere das ganze Jahr über im Wasser leben können, ohne sich an große Temperaturänderungen anpassen zu müssen (Was würde Ihrer Meinung nach passieren, wenn das Wasser leichter abkühlt? Welche Probleme könnte dies haben? gegenüber Organismen in einem kleinen Teich darstellen?). Dies bedeutet auch, dass es ziemlich schwierig ist, unsere Körpertemperatur schnell zu ändern, und daher erleichtert es unserem Gehirn die Aufrechterhaltung einer konstanten Körpertemperatur erheblich (Was kann passieren, wenn sich unsere Körpertemperatur schnell und einfach ändert?)
Oberflächenspannung
Sie haben vielleicht bemerkt, dass eine Nadel, wenn Sie sie auf die Oberfläche einer Wasserschale setzen, schwimmt, aber wenn Sie sie hineinwerfen, sinkt sie.Dies liegt daran, dass die Nadel dichter als Wasser ist und daher sinken möchte, aber durch die Oberflächenspannung des Wassers gehalten wird. Oberflächenspannung ist eine Eigenschaft, die bedeutet, dass die Wasseroberfläche nicht brechen möchte – sie ist „klebrig“. Sie können dies auch sehen, wenn Sie eine Tasse bis zum Rand füllen, da die Wasseroberfläche zusammenhält und dem Verschütten widersteht. Die hohe Oberflächenspannung des Wassers ist der Grund dafür, dass einige Fliegen auf der Oberfläche landen können, ohne zu sinken. Dieses Konzept ist auch sehr eng mit einem anderen verwandt, der Idee der Kapillarwirkung.
Kapillarwirkung
Ähnlich wie bei der Oberflächenspannung dreht sich dies um die Idee, dass Wassermoleküle zusammenkleben. Wenn Sie eine sehr feine Röhre in ein Becherglas Wasser geben, werden Sie feststellen, dass ein Teil des Wassers ein kurzes Stück die Röhre hinauf fließt. Dies wird als Kapillarwirkung bezeichnet und wird dadurch verursacht, dass das Wasser an den Seiten des Rohrs und an anderen Wassermolekülen haftet und diese mit sich nach oben zieht. Schließlich ist das Gewicht des gezogenen Wassers zu groß, um unterstützt zu werden, und das Wasser bleibt stehen, nachdem es ein Gleichgewicht erreicht hat. Das gleiche Prinzip ermöglicht es Pflanzen, Wasser aus dem Boden zu ziehen. Wenn Wassermoleküle den Stamm hinauf wandern, haften mehr Wassermoleküle an ihnen und mehr an diesen und so weiter, bis eine Wassersäule im Xylem transportiert wird (um mehr darüber zu erfahren, schlagen Sie nach „Transpiration“).
Aber warum?
Alle diese Eigenschaften von Wasser sind für das Leben, wie wir es kennen, entscheidend, aber warum hat Wasser sie? Tut keine andere Substanz diese Dinge auch? Was macht Wasser anders? Um die Antworten auf diese Fragen zu verstehen, müssen Sie die molekulare Struktur von Wasser untersuchen. Die chemische Formel für Wasser lautet H2O, was bedeutet, dass es zwei Wasserstoffatome enthält, die kovalent an ein Sauerstoffatom gebunden sind, wie folgt: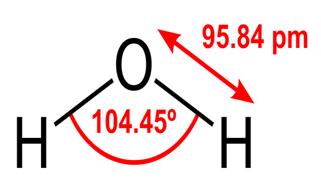
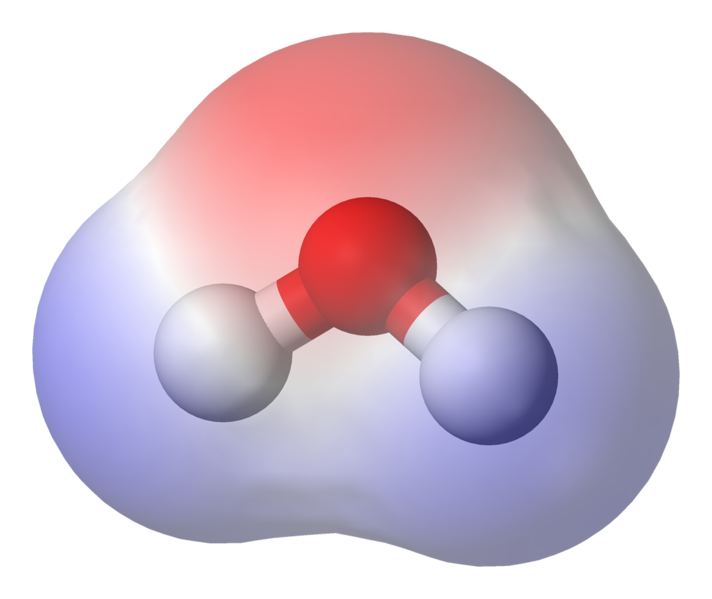
Die 95,84 pm zeigt die Länge der Bindung zwischen dem Sauerstoff und dem Wasserstoff; Eine Uhr ist kurz für ein Pikometer, das ist ein Billionstel Meter. Der gezeigte Winkel ist der spitze Winkel zwischen den beiden Wasserstoffkernen (haben Sie eine Vorstellung davon, warum es nicht „t $ 180 ^ \ circ $? Warum sollte es $ 180 ^ \ circ $ sein?“). Dieses Diagramm zeigt die Bindungen als Linien, die lässt es so aussehen, als wären sie an jedem Punkt gleich? Dies ist nicht der Fall. Da Sauerstoff elektronegativer als Wasserstoff ist, zieht er die Elektronen in der OH-Bindung zu sich selbst an. Wenn die Dicke der Linie die Elektronendichte darstellt (die Menge der Zeitelektronen) in diesem Teil der Bindung verbringen), sieht die OH-Bindung tatsächlich eher so aus:
BILD, das die Polarisation der Bindung zeigt
Wie Sie sehen können, verbringen die Elektronen die meiste Zeit näher am Sauerstoffkern Sauerstoff ist leicht negativ geladen und die Wasserstoffatome sind leicht positiv geladen. Dies wird als Polarität bezeichnet und ist das Schlüsselkonzept für die Eigenschaften von Wasser.
Dies bedeutet, dass schwache ionische Wechselwirkungen zwischen n auftreten können benachbarte Wassermoleküle als leicht positiver Wasserstoff eines Moleküls werden vom leicht negativen Sauerstoff eines anderen Moleküls angezogen. Diese werden als Wasserstoffbrücken bezeichnet.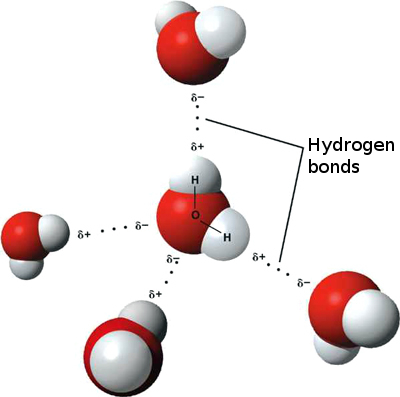
Deshalb „haftet“ Wasser an sich selbst, was ihm eine hohe Oberflächenspannung und die Fähigkeit gibt, sich durch Kapillarwirkung zu bewegen.
Zum Abbau der Wasserstoffbrückenbindungen wird viel Energie benötigt, weshalb der Schmelz- und Siedepunkt von Wasser hoch ist und eine hohe spezifische Wärmekapazität aufweist.
Eine Substanz löst sich in Wasser auf, wenn sie polar ist oder ionisch. Dies liegt daran, dass es sich durch Bildung von Wasserstoffbrückenbindungen mit dem Wasser auflöst. Öl ist nicht polar, weshalb es sich nicht auflöst. Salz, NaCl, löst sich auf, weil es ionisch ist. Können Sie sich einige andere Substanzen vorstellen, die wasserlöslich sind? Wie bilden sie damit Wasserstoffbrücken? Können Sie ein ähnliches Bild wie das folgende zeichnen, das zeigt, warum Glucose löslich ist? Ist es mehr oder weniger wasserlöslich als Salz? Warum ist das Ihrer Meinung nach so?
Ein Diagramm darüber, was mit NaCl in Lösung passiert:
