¿Por qué la gente dice que el agua es necesaria para la vida? ¿Por qué nunca hemos encontrado ningún organismo vivo que pueda florecer en un ambiente completamente seco? ¿Cómo es que algo inodoro, incoloro, insípido y relativamente poco reactivo constituye el 60% de nuestra masa corporal? ¿Por qué no podría usarse otro líquido? ¿Por qué el agua?
El agua tiene varias propiedades que la hacen única entre los compuestos y hacen posible que funcionen todas las formas de vida conocidas.
Es la única sustancia natural que se encuentra en los tres estados físicos a las temperaturas que ocurren naturalmente en la Tierra.
Esto significa que vemos el agua como un líquido, en los ríos y mares, un sólido, como la nieve y el hielo, y como un gas, como las nubes o el vapor. Si este no fuera el caso, el ciclo del agua sería completamente diferente (¿y si el agua no se evaporara con el sol?); La nieve y el hielo podrían no existir (y miles de especies ahora estarían sin hogar) y el clima sería muy diferente ( ¿seguiría lloviendo?). ¿Puedes pensar en algo más que sería diferente? ¿Crees que aún podríamos vivir si el agua fuera solo un líquido a las temperaturas que ocurren naturalmente en la Tierra? ¿Qué tal solo un gas / sólido?
El hielo es menos denso que el agua
Esto solo significa que el hielo flota en el agua y que los lagos se congelan de arriba hacia abajo. Esto es claramente importante para los animales que viven en el hielo, ya que sus hábitats se reducirían considerablemente o no existirían. si el hielo se hundiera. Del mismo modo, los peces y otras formas de vida de los estanques se verían afectados si los lagos y estanques se congelaran de abajo hacia arriba; la capa de agua congelada en la parte superior del estanque proporciona algo de aislamiento y evita que el resto del agua se enfríe cuando rápidamente. Para ello, crea una barrera entre el frío aire y agua debajo. Esto significa que las masas de agua grandes no se enfrían más profundamente en el fondo tan rápido como lo harían si el hielo se hundiera y ayuda a la vida silvestre a sobrevivir en los estanques durante el invierno. De hecho, el agua se vuelve más densa cuando se enfría hasta que alcanza los $ 4 ^ \ circ $ C (que puede ver en el gráfico), después de lo cual se vuelve menos denso nuevamente. La mayoría de las sustancias se vuelven progresivamente más densas a medida que se enfrían. El siguiente gráfico muestra cómo cambia la densidad del agua con la temperatura.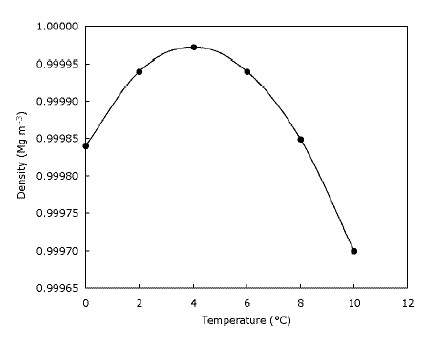
El agua tiene un punto de fusión y ebullición muy alto en comparación con otras moléculas similares
Esto es lo que significa que se considera un sólido, un líquido y un gas en la Tierra. Si el agua no fuera un líquido en la mayoría de las temperaturas que vemos en la Tierra, los mares serían todos hielo, no habría lluvia, nada para que las plantas recolectaran y los animales bebieran. Incluso nuestras células están llenas de agua líquida, lo que tampoco sería posible.
Se le llama el «solvente universal» porque es capaz de disolver muchas sustancias.
El agua en nuestros cuerpos i s contenido principalmente en nuestras células, donde les da una forma clara, además de tener miles de millones de moléculas útiles disueltas en él. Nuestras células necesitan estar llenas de agua para que funcionen correctamente porque las enzimas en su interior solo funcionan en solución. El agua también es el medio por el cual se produce el transporte en nuestros cuerpos «la sangre es principalmente agua y tiene hormonas y gases disueltos inicialmente, así como toxinas como la urea, que se eliminan del cuerpo con aún más agua. El transporte en agua también ocurre en un escala mucho más pequeña: cuando algo se disuelve, puede moverse en el solvente. Por ejemplo, si una enzima necesita iones de calcio para activarse y comenzar a trabajar, los encontrará a medida que se muevan en la solución dentro de una célula. Cuanto mayor sea la concentración de calcio en la célula, es más probable que la enzima se encuentre con un ión antes. También es posible que haya aprendido sobre la difusión y la ósmosis, que son conceptos clave para comprender cómo funcionan las células y dependen de la presencia de agua.
El agua tiene un alto contenido específico capacidad de calor.
Si bien esta idea suena un poco intimidante, en realidad es muy simple: todo lo que significa es que se necesita mucha energía para calentar un poco el agua. Por eso, en un día caluroso, la arena de una playa puede hacer demasiado calor para caminar encendido pero el mar todavía se siente fresco; la energía del sol es suficiente para calentar mucho la arena, pero el agua solo un poco. Esto tiene algunas implicaciones muy importantes, especialmente para los organismos que viven en el agua. Los mares, lagos y ríos mantienen una temperatura mucho más constante que el aire, lo que significa que los animales pueden vivir en el agua todo el año sin tener que adaptarse a los grandes cambios de temperatura (¿Qué crees que pasaría si el agua se enfriara más fácilmente? plantean a los organismos que viven en un estanque pequeño?). Esto también significa que la temperatura de nuestro cuerpo es razonablemente difícil de cambiar rápidamente y, por lo tanto, hace que el trabajo de nuestro cerebro de mantener una temperatura corporal constante sea mucho más fácil (¿Qué podría suceder si la temperatura de nuestro cuerpo cambiara rápida y fácilmente?). Tensión superficial
Puede que hayas notado que si pones una aguja en la superficie de un recipiente con agua, flota pero si la arrojas se hunde.Esto se debe a que la aguja es más densa que el agua, por lo que quiere hundirse, pero la tensión superficial del agua la retiene. La tensión superficial es una propiedad que significa que la superficie del agua no quiere romperse, es «pegajosa». También puede ver esto cuando llena una taza hasta el borde, ya que la superficie del agua se mantendrá unida y resistirá los derrames. La alta tensión superficial del agua es la razón por la que algunas moscas pueden aterrizar en su superficie sin hundirse. Este concepto también está muy relacionado con otro, la idea de acción capilar.
Acción capilar
De manera similar a la tensión superficial, esto gira en torno a la idea de que las moléculas de agua se «pegan». Si coloca un tubo muy fino en un vaso de precipitados con agua, verá que parte del agua sube un poco por el tubo; esto se llama acción capilar y es causado por el agua que se adhiere a los lados del tubo y a otras moléculas de agua, tirando de ellas hacia arriba por el tubo. Finalmente, el peso del agua que se tira es demasiado grande para ser soportado y el agua deja de moverse, habiendo alcanzado un equilibrio. Este mismo principio permite que las plantas extraigan agua del suelo; a medida que las moléculas de agua suben por el tallo, más moléculas de agua se adhieren a ellas y más se adhieren a ellas, y así sucesivamente hasta que se transporta una columna de agua en el xilema (para obtener más información sobre esto, busque «transpiración»).
¿Pero por qué?
Todas estas propiedades del agua son críticas para la vida tal como la conocemos, pero ¿por qué el agua las tiene? ¿Ninguna otra sustancia también hace estas cosas? ¿Qué tiene el agua que la hace diferente? Para comprender las respuestas a estas preguntas, debe estudiar la estructura molecular del agua. La fórmula química del agua es H2O, lo que significa que contiene dos átomos de hidrógeno unidos covalentemente a un átomo de oxígeno, como este: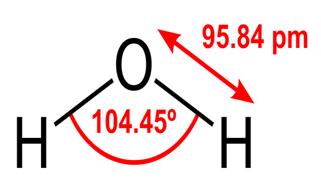
El 95.84pm muestra la longitud del enlace entre el oxígeno y el hidrógeno; una pm es la abreviatura de un picómetro, que es una billonésima parte de un metro. El ángulo que se muestra es el ángulo agudo entre los dos núcleos de hidrógeno (¿tiene alguna idea de por qué no es «t $ 180 ^ \ circ $? ¿Por qué debería ser $ 180 ^ \ circ $?). Este diagrama representa los enlaces como líneas, que hace que parezca que son iguales en todos los puntos? Este no es el caso. Debido a que el oxígeno es más electronegativo que el hidrógeno, atrae los electrones en el enlace OH hacia sí mismo. Si el grosor de la línea representa la densidad de electrones (la cantidad de tiempo que los electrones gastan en esa parte del enlace), el enlace OH en realidad se parece más a esto:
IMAGEN que muestra la polarización del enlace
Como puede ver, los electrones pasan la mayor parte de su tiempo más cerca del núcleo de oxígeno. Esto significa que el el oxígeno tiene una carga ligeramente negativa y los hidrógenos tienen una carga ligeramente positiva. Esto se llama polaridad y es el concepto clave detrás de las propiedades del agua
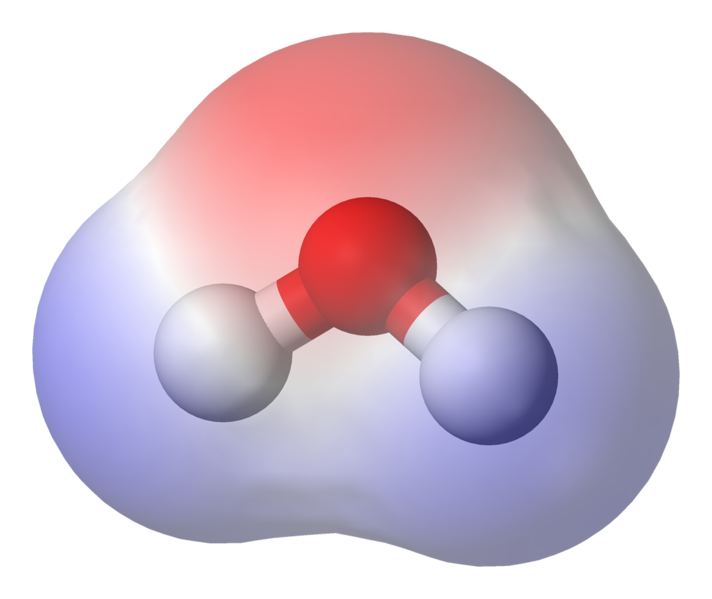
Esto significa que pueden ocurrir interacciones iónicas débiles entre n moléculas de agua vecinas, ya que el hidrógeno ligeramente positivo de una molécula es atraído por el oxígeno ligeramente negativo de otra. Estos se denominan enlaces de hidrógeno.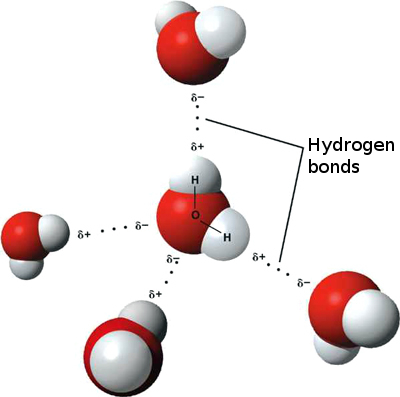
Es por eso que el agua se «pega» a sí misma, lo que le otorga una alta tensión superficial y la capacidad de moverse por capilaridad.
Se requiere una gran cantidad de energía para romper los enlaces de hidrógeno, por lo que los puntos de fusión y ebullición del agua son altos y tiene una alta capacidad calorífica específica.
Una sustancia se disolverá en agua si es polar o iónico. Esto se debe a que se disuelve formando enlaces de hidrógeno con el agua. El aceite no es polar, por eso no se disuelve. La sal, NaCl, se disuelve porque es iónica. ¿Puedes pensar en otras sustancias que sean solubles en agua? ¿Cómo forman enlaces de hidrógeno con él? ¿Puede hacer un dibujo similar al de abajo que muestre por qué la glucosa es soluble? ¿Es más o menos soluble en agua que la sal? ¿Por qué crees que es esto?
Un diagrama de lo que le sucede al NaCl en solución:
