Waarom zeggen mensen dat water noodzakelijk is voor het leven? Waarom hebben we nog nooit een levend organisme gevonden dat kan gedijen in een volledig droge omgeving? Hoe komt het dat iets geurloos, kleurloos, smaakloos en relatief niet-reactief 60% van onze lichaamsmassa uitmaakt? Waarom kan geen andere vloeistof worden gebruikt? Waarom water?
Water heeft verschillende eigenschappen die het uniek maken onder de verbindingen en het mogelijk maken dat alle vormen van bekend leven functioneren.
Het is de enige natuurlijke stof die in alle drie de fysische toestanden wordt aangetroffen bij de temperaturen die van nature voorkomen op aarde.
Dit betekent dat we water zien als een vloeistof, in rivieren en zeeën, als een vaste stof, als sneeuw en ijs, en als gas, als wolken of stoom. Als dit niet het geval was, zou de waterkringloop compleet anders zijn (wat als water niet verdampt in de zon?); Sneeuw en ijs zouden misschien niet bestaan (en duizenden soorten zouden nu dakloos zijn) en het weer zou heel anders zijn ( Zou het nog steeds regenen?). Kun je nog iets anders bedenken dat anders zou zijn? Denk je dat we nog steeds zouden kunnen leven als water alleen een vloeistof was bij de temperaturen die van nature op aarde voorkomen? Hoe zit het met alleen een gas / vaste stof?
IJs is minder dicht dan water
Dit betekent alleen dat ijs op water drijft en dat meren van boven naar beneden bevriezen. Dit is duidelijk belangrijk voor dieren die op ijs leven, omdat hun leefgebied sterk zou afnemen of niet zou bestaan als het ijs zou zinken. Evenzo zouden vissen en ander vijverleven worden aangetast als meren en vijvers van beneden naar boven bevriezen – de laag bevroren water aan de bovenkant van de vijver zorgt voor enige isolatie en voorkomt dat de rest van het water koud wordt Het doet dit door een barrière te maken tussen de kou lucht en het water eronder. Dit betekent dat grote watermassa’s niet zo snel dieper koud worden als het zou kunnen als het ijs zinkt en dieren in het wild helpen overleven in vijvers in de winter. Het water wordt zelfs dichter wanneer het wordt afgekoeld tot het $ 4, – bereikt. C (die je kunt zien op de grafiek), waarna het weer minder dicht wordt. De meeste stoffen worden steeds dichter naarmate ze afkoelen. De onderstaande grafiek laat zien hoe de dichtheid van water verandert met de temperatuur.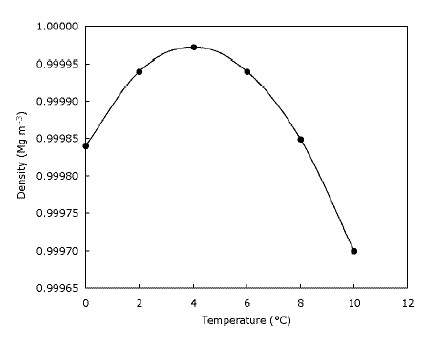
Water heeft een zeer hoog smelt- en kookpunt in vergelijking met andere vergelijkbare moleculen
Dit betekent dat het wordt gezien als een vaste stof, een vloeistof en een gas op aarde. Als water geen vloeibaar bij de meeste temperaturen die we op aarde zien, de zeeën zouden allemaal ijs zijn, er zou geen regen zijn, niets voor planten om te verzamelen en dieren om te drinken. Zelfs onze cellen zijn gevuld met vloeibaar water, wat ook niet mogelijk zou zijn. br> Het wordt het “universele oplosmiddel” genoemd omdat het zoveel stoffen kan oplossen.
Het water in ons lichaam i Ze bevinden zich meestal in onze cellen, waar ze een duidelijke vorm krijgen en er miljarden nuttige moleculen in zijn opgelost. Onze cellen moeten met water worden gevuld om goed te kunnen werken, omdat de enzymen erin alleen in oplossing werken. Water is ook het middel waarmee transport in ons lichaam plaatsvindt. ‘Bloed is meestal water en heeft hormonen en gassen opgelost in het begin, evenals gifstoffen zoals ureum, die met nog meer water uit het lichaam worden verwijderd. Transport in water vindt ook plaats op een veel kleinere schaal: wanneer iets wordt opgelost, kan het zich verplaatsen in het oplosmiddel. Als een enzym bijvoorbeeld calciumionen nodig heeft om geactiveerd te worden en te gaan werken, zal het deze opvangen wanneer ze zich verplaatsen in de oplossing in een cel. Hoe hoger de concentratie van calcium in de cel, hoe groter de kans dat het enzym eerder een ion ontmoet. Mogelijk hebt u ook geleerd over diffusie en osmose, die sleutelbegrippen zijn om te begrijpen hoe cellen functioneren en vertrouwen op de aanwezigheid van water
Water heeft een hoge specifieke warmtecapaciteit.
Hoewel dit idee een beetje intimiderend klinkt, is het eigenlijk heel simpel – het betekent alleen dat het veel energie kost om water een beetje warmer te maken. Dit is de reden waarom op een warme dag het zand op een strand kan te warm zijn om te lopen maar de zee voelt nog steeds koel aan; de energie van de zon is voldoende om het zand veel te verwarmen, maar het water maar een beetje. Dit heeft enkele zeer belangrijke implicaties, vooral voor organismen die in water leven. Zeeën, meren en rivieren hebben een veel constantere temperatuur dan lucht, wat betekent dat dieren het hele jaar door in water kunnen leven zonder zich aan te hoeven passen aan grote temperatuurveranderingen (wat zou er volgens jou gebeuren als het water gemakkelijker zou afkoelen? poseren voor organismen die in een kleine vijver leven?). Dit betekent ook dat het redelijk moeilijk is om onze lichaamstemperatuur snel te veranderen, waardoor het voor onze hersenen veel gemakkelijker wordt om een constante lichaamstemperatuur te handhaven (wat kan er gebeuren als onze lichaamstemperatuur snel en gemakkelijk verandert?).
Oppervlaktespanning
Het is je misschien opgevallen dat als je een naald op het oppervlak van een kom met water zet, deze drijft, maar als je hem erin gooit, zinkt.Dit komt doordat de naald dichter is dan water en wil zinken, maar wordt tegengehouden door de oppervlaktespanning van het water. Oppervlaktespanning is een eigenschap die betekent dat het wateroppervlak niet wil breken – het is “plakkerig”. Je kunt dit ook zien als je een kopje tot de rand vult, omdat het wateroppervlak bij elkaar blijft en niet morst. De hoge oppervlaktespanning van water is de reden dat sommige vliegen op het oppervlak kunnen landen zonder te zinken. Dit concept is ook zeer nauw verwant aan een ander concept, het idee van capillaire werking.
Capillaire werking
Net als bij oppervlaktespanning draait dit om het idee dat watermoleculen aan elkaar ‘plakken’. Als je een heel fijne buis in een beker water doet, zul je zien dat een deel van het water een klein stukje door de buis gaat; dit wordt capillaire werking genoemd en wordt veroorzaakt doordat het water zich aan de zijkanten van de buis en aan andere watermoleculen vastklampt en ze daarmee door de buis omhoog trekt. Uiteindelijk is het gewicht van het getrokken water te groot om te worden ondersteund en stopt het water met bewegen nadat het een evenwicht heeft bereikt. Door ditzelfde principe kunnen planten water uit de grond halen; naarmate watermoleculen de stengel opgaan, blijven er meer watermoleculen aan vastplakken en blijven er meer aan vast, enzovoort, totdat een kolom water in het xyleem wordt getransporteerd (zoek voor meer informatie naar ‘transpiratie’).
Maar waarom?
Al deze eigenschappen van water zijn cruciaal voor het leven zoals we het kennen, maar waarom heeft water ze? Doet geen enkele andere stof deze dingen ook? Waar gaat het over water dat het anders maakt? Om de antwoorden op deze vragen te begrijpen, moet je de moleculaire structuur van water bestuderen. De chemische formule voor water is H2O, wat betekent dat het twee waterstofatomen bevat die covalent zijn gebonden aan één zuurstofatoom, zoals deze: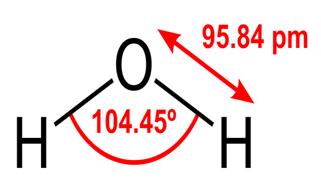
De 95.84pm toont de lengte van de binding tussen de zuurstof en de waterstof; één uur ’s middags is een afkorting van een picometer, wat neerkomt op een biljoenste van een meter. De getoonde hoek is de scherpe hoek tussen de twee waterstofkernen (heb je enig idee waarom het niet $ 180 ^ \ circ $ is? Waarom zou het $ 180 ^ \ circ $ zijn?) Dit diagram stelt de bindingen voor als lijnen, die laat het lijken alsof ze op elk punt hetzelfde zijn? Dit is niet het geval. Omdat zuurstof elektronegatiever is dan waterstof, trekt het de elektronen in de OH-binding naar zichzelf toe. Als de dikte van de lijn de elektronendichtheid vertegenwoordigt (de hoeveelheid tijd elektronen in dat deel van de binding), ziet de OH-binding er eigenlijk meer als volgt uit:
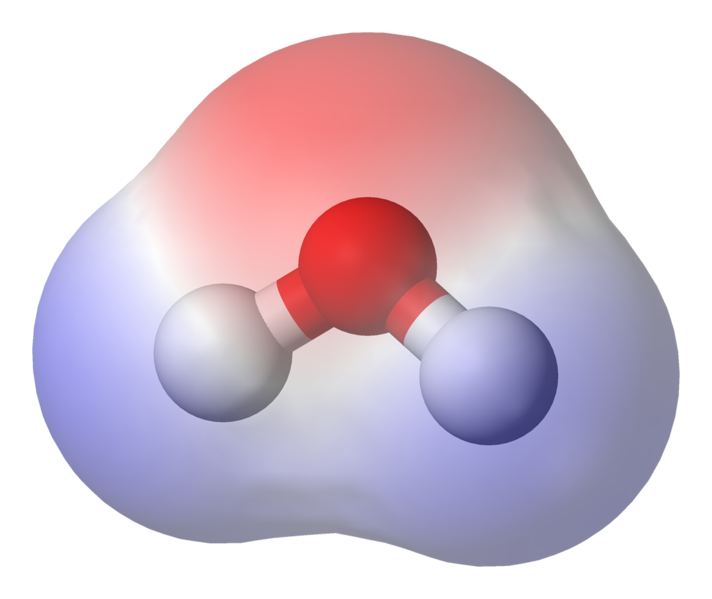
AFBEELDING toont polarisatie van de binding
Zoals je kunt zien brengen de elektronen het grootste deel van hun tijd dichter bij de zuurstofkern door. Dit betekent dat de zuurstof is licht negatief geladen en de waterstofatomen zijn licht positief geladen. Dit wordt polariteit genoemd en is het sleutelconcept achter de eigenschappen van water
Dit betekent dat er zwakke ionische interacties kunnen optreden tussen n naburige watermoleculen als de licht positieve waterstof van het ene molecuul wordt aangetrokken door de licht negatieve zuurstof op een ander. Dit worden waterstofbruggen genoemd.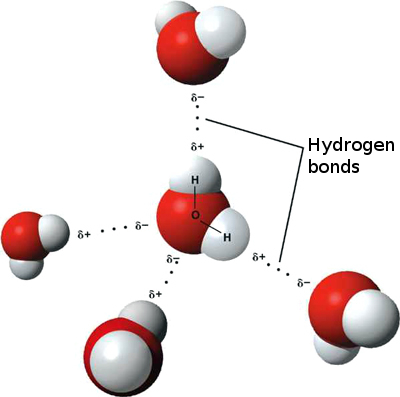
Dit is de reden waarom water aan zichzelf “kleeft”, waardoor het een hoge oppervlaktespanning krijgt en het vermogen om te bewegen door capillaire werking.
Er is veel energie nodig om de waterstofbruggen af te breken, daarom zijn de smelt- en kookpunten van water hoog en heeft het een hoge soortelijke warmtecapaciteit
Een stof lost op in water als het polair of ionisch. Dit komt omdat het oplost door waterstofbruggen met het water te vormen. Olie is niet polair, daarom lost het niet op. Zout, NaCl, lost wel op omdat het ionisch is. Kun je nog andere stoffen bedenken die in water oplosbaar zijn? Hoe vormen ze er waterstofbruggen mee? Kun je een soortgelijke afbeelding maken als hieronder, die laat zien waarom glucose oplosbaar is? Is het meer of minder oplosbaar in water dan zout? Waarom denk je dat dit is?
Een diagram van wat er met NaCl in oplossing gebeurt:
