Por que as pessoas dizem que a água é necessária para a vida? Por que nunca encontramos nenhum organismo vivo que pudesse florescer em um ambiente completamente seco? Como é que algo inodoro, incolor, insípido e relativamente não reativo constitui 60% da nossa massa corporal? Por que outro líquido não pode ser usado? Por que água?
A água tem várias propriedades que a tornam única entre os compostos e possibilitam o funcionamento de todas as formas de vida conhecidas.
É a única substância natural encontrada em todos os três estados físicos nas temperaturas que ocorrem naturalmente na Terra.
Isso significa que vemos a água como um líquido, em rios e mares, um sólido, como neve e gelo, e como um gás, como nuvens ou vapor. Se este não fosse o caso, o ciclo da água seria completamente diferente (e se a água não evaporasse no sol?); Neve e gelo podem não existir (e milhares de espécies estariam agora sem teto) e o clima seria muito diferente ( ainda choveria?). Você consegue pensar em mais alguma coisa que seria diferente? Você acha que ainda poderíamos viver se a água fosse apenas um líquido nas temperaturas que ocorrem naturalmente na Terra? Que tal apenas um gás / sólido?
O gelo é menos denso que a água
Isso significa apenas que o gelo flutua na água e que os lagos congelam de cima para baixo. Isso é claramente importante para os animais que vivem no gelo, pois seus habitats seriam muito reduzidos ou não existiriam se o gelo afundar. Da mesma forma, os peixes e outras formas de vida no lago seriam afetados se os lagos e lagoas congelassem de baixo para cima – a camada de água congelada no topo do lago fornece algum isolamento e evita que o resto da água esfrie conforme rapidamente. Isso é feito criando uma barreira entre o frio ar e água abaixo. Isso significa que grandes massas de água não ficam mais resfriadas tão rápido quanto poderiam se o gelo afundasse e ajudasse a vida selvagem a sobreviver em lagoas durante o inverno. Na verdade, a água fica mais densa quando é resfriada até atingir $ 4 ^ \ circ $ C (que você pode ver no gráfico), depois do qual fica menos denso novamente. A maioria das substâncias fica progressivamente mais densa à medida que são resfriadas. O gráfico abaixo mostra como a densidade da água muda com a temperatura.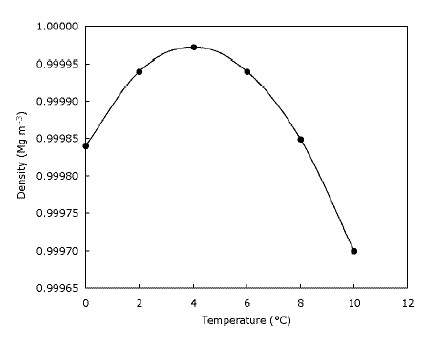
A água tem um ponto de fusão e ebulição muito alto em comparação com outras moléculas semelhantes
Isso significa que ela é vista como um sólido, um líquido e um gás na Terra. Se a água não fosse um líquido na maioria das temperaturas que vemos na Terra, os mares seriam todos gelo, não haveria chuva, nada para as plantas coletarem e os animais beberem. Até mesmo nossas células estão cheias de água líquida, o que também não seria possível.
É chamado de “solvente universal” porque é capaz de dissolver muitas substâncias.
A água em nossos corpos i Está principalmente contido em nossas células, onde lhes dá uma forma clara, além de ter bilhões de moléculas úteis dissolvidas nele. Nossas células precisam ser preenchidas com água para funcionar corretamente, porque as enzimas dentro delas só funcionam em solução. A água também é o meio pelo qual o transporte ocorre em nossos corpos “o sangue é principalmente água e tem hormônios e gases dissolvidos, bem como toxinas, como a uréia, que são removidas do corpo com ainda mais água. O transporte na água também ocorre em um escala muito menor: quando algo está dissolvido, ele pode se mover no solvente. Por exemplo, se uma enzima precisa de íons de cálcio para ser ativada e começar a funcionar, ela os encontrará à medida que se movem na solução dentro de uma célula. Quanto maior a concentração de cálcio na célula, é mais provável que a enzima encontre um íon mais cedo. Você também pode ter aprendido sobre difusão e osmose, que são conceitos-chave para entender como as células funcionam e dependem da presença de água
A água tem uma alta especificidade capacidade de calor.
Embora essa ideia pareça um pouco intimidante, na verdade é muito simples – tudo o que significa é que é preciso muita energia para tornar a água um pouco mais quente. É por isso que, em um dia quente, a areia da praia pode estar muito quente para andar em frente, mas o mar ainda está fresco; a energia do sol é suficiente para aquecer muito a areia, mas a água apenas um pouco. Isso tem algumas implicações muito importantes, especialmente para organismos que vivem na água. Mares, lagos e rios mantêm uma temperatura muito mais constante do que o ar, o que significa que os animais podem viver na água durante todo o ano sem ter que se adaptar a grandes mudanças de temperatura (o que você acha que aconteceria se a água resfriasse mais facilmente? Que problemas podem isso representam para organismos que vivem em um pequeno lago?). Isso também significa que a temperatura do nosso corpo é razoavelmente difícil de mudar rapidamente e, portanto, torna o trabalho do nosso cérebro de manter uma temperatura corporal constante muito mais fácil (o que poderia acontecer se a temperatura do nosso corpo mudasse rápida e facilmente?).
Tensão superficial
Você deve ter notado que, se colocar uma agulha na superfície de uma tigela com água, ela flutua, mas se você jogá-la afunda.Isso ocorre porque a agulha é mais densa do que a água e, por isso, quer afundar, mas é sustentada pela tensão superficial da água. A tensão superficial é uma propriedade que significa que a superfície da água não quer quebrar – ela é “pegajosa”. Você também pode ver isso quando encher um copo até a borda, pois a superfície da água se manterá unida e resistirá ao derramamento. A alta tensão superficial da água é a razão de algumas moscas pousarem em sua superfície sem afundar. Esse conceito também está intimamente relacionado a outro, a ideia de ação capilar.
Ação capilar
Assim como a tensão superficial, ela gira em torno da ideia de que as moléculas de água “se unem”. Se você colocar um tubo muito fino em um copo d’água, verá que parte da água sobe um pouco pelo tubo; isso é chamado de ação capilar e é causado pela água grudada nas laterais do tubo e em outras moléculas de água, puxando-as para cima com ela. Eventualmente, o peso da água sendo puxada é muito grande para ser suportado e a água para de se mover, tendo atingido um equilíbrio. Este mesmo princípio permite que as plantas tirem água do solo; conforme as moléculas de água sobem pelo caule, mais moléculas de água aderem a elas e mais aderem a elas e assim por diante, até que uma coluna de água seja transportada no xilema (para saber mais sobre isso, pesquise “transpiração”).
Mas por quê?
Todas essas propriedades da água são críticas para a vida como a conhecemos, mas por que a água as possui? Nenhuma outra substância também faz essas coisas? O que a torna diferente na água? Para entender as respostas a essas perguntas, você precisa estudar a estrutura molecular da água. A fórmula química da água é H2O, o que significa que ela contém dois átomos de hidrogênio covalentemente ligados a um átomo de oxigênio, como este: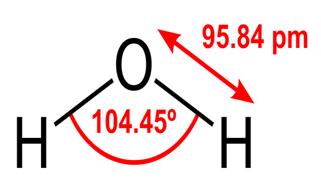
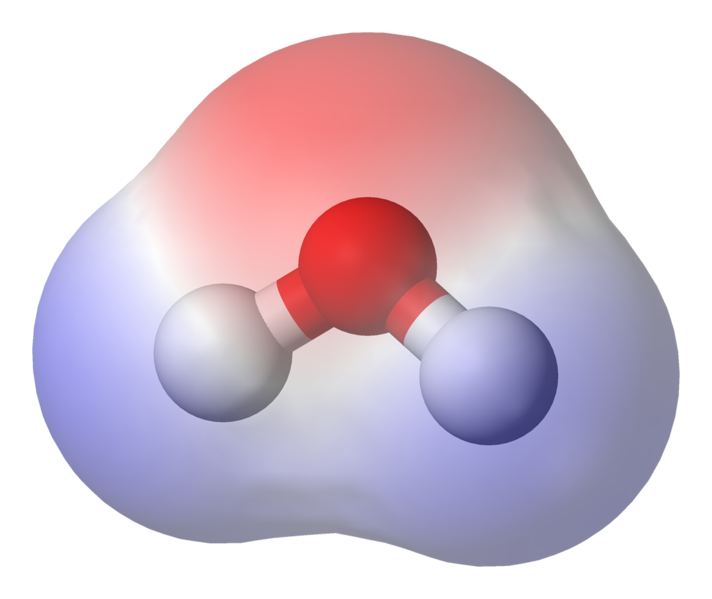
O 95,84 pm mostra o comprimento do ligação entre o oxigênio e o hidrogênio; 13h é a abreviação de um picômetro, que é um trilionésimo de metro. O ângulo mostrado é o ângulo agudo entre os dois núcleos de hidrogênio (você tem alguma ideia sobre por que não é “t $ 180 ^ \ circ $? Por que deveria ser $ 180 ^ \ circ $?) Este diagrama representa as ligações como linhas, que faz com que pareçam iguais em todos os pontos? não é o caso. Como o oxigênio é mais eletronegativo do que o hidrogênio, ele atrai os elétrons da ligação OH para si mesmo. Se a espessura da linha representar a densidade do elétron (a quantidade de elétrons de tempo passam nessa parte da ligação), a ligação OH realmente se parece mais com isto:
IMAGEM mostrando a polarização da ligação
Como você pode ver, os elétrons passam a maior parte do tempo mais próximos do núcleo de oxigênio. Isso significa que o o oxigênio tem carga ligeiramente negativa e os hidrogênios são levemente carregados positivamente. Isso é chamado de polaridade e é o conceito-chave por trás das propriedades da água
Isso significa que interações iônicas fracas podem ocorrer entre n As moléculas de água vizinhas à medida que o hidrogênio levemente positivo de uma molécula é atraído pelo oxigênio levemente negativo de outra. Elas são chamadas de ligações de hidrogênio.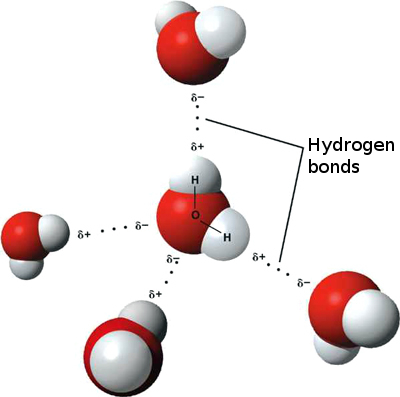
É por isso que a água “gruda” em si mesma, dando-lhe alta tensão superficial e a capacidade de se mover por ação capilar.
Uma grande quantidade de energia é necessária para quebrar as ligações de hidrogênio, razão pela qual os pontos de fusão e ebulição da água são altos e por que ela tem uma alta capacidade de calor específico
Uma substância se dissolverá na água se for polar ou iônico. Isso ocorre porque ele se dissolve formando ligações de hidrogênio com a água. O petróleo não é polar, por isso não se dissolve. O sal, NaCl, se dissolve porque é iônico. Você consegue pensar em algumas outras substâncias que são solúveis em água? Como eles formam ligações de hidrogênio com ele? Você pode fazer um desenho semelhante ao que está abaixo, mostrando por que a glicose é solúvel? É mais ou menos solúvel em água do que sal? Por que você acha que isso acontece?
Um diagrama do que acontece com o NaCl na solução:
