De ce spun oamenii că apa este necesară pentru viață? De ce nu am găsit niciodată vreun organism viu care să poată înflori într-un mediu complet uscat? Cum se face că ceva inodor, incolor, insipid și relativ nereactiv reprezintă 60% din masa noastră corporală? De ce nu ar putea fi folosit un alt lichid? De ce apa?
Apa are mai multe proprietăți care o fac unică printre compuși și fac posibilă funcționarea tuturor formelor de viață cunoscute.
Este singura substanță naturală găsită în toate cele trei stări fizice la temperaturile care apar în mod natural. pe Pământ.
Aceasta înseamnă că vedem apa ca un lichid, în râuri și mări, ca un solid, ca zăpadă și gheață și ca un gaz, ca nori sau aburi. Dacă nu ar fi cazul, ciclul apei ar fi complet diferit (ce se întâmplă dacă apa nu s-ar evapora la soare?); Zăpada și gheața ar putea să nu existe (iar mii de specii ar fi acum fără adăpost) și vremea ar fi foarte diferită ( mai plouă?). Vă puteți gândi la orice altceva care ar fi diferit? Crezi că am putea trăi în continuare dacă apa ar fi doar un lichid la temperaturile care apar în mod natural pe Pământ? Ce se întâmplă doar cu un gaz / solid?
Gheața este mai puțin densă decât apa
Aceasta înseamnă doar că gheața plutește pe apă și că lacurile îngheață de sus în jos. Acest lucru este clar important pentru animalele care trăiesc pe gheață, deoarece habitatele lor ar fi mult reduse sau nu ar exista în mod similar, peștele și alte iazuri ar fi afectate dacă lacurile și iazurile ar îngheța de jos în sus – stratul de apă înghețată din partea de sus a iazului oferă o anumită izolație și împiedică restul apei să se răcească ca face acest lucru făcând o barieră între frig aerul și apa de dedesubt. Aceasta înseamnă că corpurile mari de apă nu se răcesc mai adânc cât de repede ar putea dacă s-ar scufunda gheața și ajută viața sălbatică să supraviețuiască în iazuri în timpul iernii. De fapt, apa devine mai densă la răcire până ajunge la 4 $ ^ \ circ $ C (pe care îl puteți vedea pe grafic), după care devine din nou mai puțin dens. Majoritatea substanțelor devin progresiv mai dense pe măsură ce sunt răcite. Graficul de mai jos arată modul în care densitatea apei se modifică cu temperatura.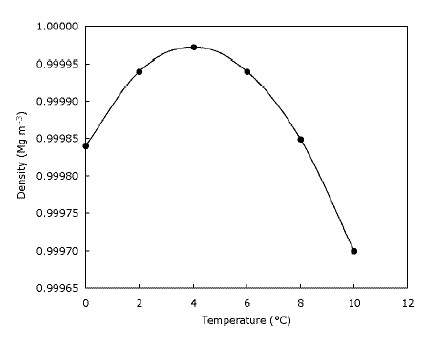
Apa are un punct de topire și fierbere foarte ridicat în comparație cu alte molecule similare
Aceasta înseamnă că este văzută ca un solid, un lichid și un gaz pe Pământ. Dacă apa nu ar fi lichid la majoritatea temperaturilor pe care le vedem pe Pământ mările ar fi toate gheață, nu ar fi ploaie, nimic de plantat de colectat și animale de băut. Chiar și celulele noastre sunt umplute cu apă lichidă, ceea ce nici nu ar fi posibil.
Se numește „solvent universal”, deoarece este capabil să dizolve atâtea substanțe.
Apa din corpul nostru i Este cel mai mult conținut în celulele noastre, unde le oferă o formă clară, precum și având miliarde de molecule utile dizolvate în ea. Celulele noastre trebuie să fie umplute cu apă pentru a funcționa corect, deoarece enzimele din interiorul lor funcționează numai în soluție. Apa este, de asemenea, mijlocul prin care are loc transportul în corpul nostru „sângele este în mare parte apă și are hormoni și gaze dizolvate inițial, precum și toxine precum ureea, care sunt îndepărtate din corp cu încă mai multă apă. Transportul în apă are loc, de asemenea, pe o scară mult mai mică: atunci când ceva este dizolvat se poate deplasa în solvent. De exemplu, dacă o enzimă are nevoie de ioni de calciu pentru a fi activată și începe să funcționeze, aceasta se va întâlni pe măsură ce se deplasează în soluția din interiorul unei celule. de calciu în celulă, cu atât mai probabil enzima va întâlni un ion mai devreme. Este posibil să fi învățat și despre difuzie și osmoză, care sunt concepte cheie în înțelegerea modului în care funcționează celulele și se bazează pe prezența apei. Apa are un capacitate de căldură.
Deși această idee sună un pic intimidantă, este de fapt foarte simplă – tot ceea ce înseamnă este că este nevoie de multă energie pentru a face apa puțin mai caldă. De aceea, într-o zi fierbinte, nisipul de pe o plajă poate fi prea cald pentru a merge dar marea încă se simte răcoroasă; energia de la soare este suficientă pentru a încălzi mult nisipul, dar apa doar puțin. Acest lucru are câteva implicații foarte importante, în special pentru organismele care trăiesc în apă. Mările, lacurile și râurile mențin o temperatură mult mai constantă decât aerul, ceea ce înseamnă că animalele pot trăi în apă pe tot parcursul anului fără a fi nevoie să se adapteze la schimbări mari de temperatură (Ce credeți că s-ar întâmpla dacă apa s-ar răci mai ușor? Ce probleme ar putea avea acest lucru prezintă organismelor care trăiesc într-un mic iaz?). Acest lucru înseamnă, de asemenea, că temperatura corpului nostru este destul de dificil de modificat rapid și, prin urmare, face ca sarcina creierului nostru de a menține o temperatură corporală constantă mult mai ușoară (Ce s-ar putea întâmpla dacă temperatura corpului nostru s-ar schimba rapid și ușor?). > S-ar putea să fi observat că, dacă puneți un ac pe suprafața unui castron cu apă, acesta plutește, dar dacă îl aruncați în el se scufundă.Acest lucru se datorează faptului că acul este mai dens decât apa, așa că vrea să se scufunde, dar este susținut de tensiunea superficială a apei. Tensiunea superficială este o proprietate care înseamnă că suprafața apei nu vrea să se spargă – este „lipicioasă”. Puteți vedea acest lucru și atunci când umpleți o ceașcă până la margine, deoarece suprafața apei se va menține împreună și va rezista la vărsare. Tensiunea superficială ridicată a apei este motivul pentru care unele muște pot ateriza pe suprafața sa fără a se scufunda. Acest concept este, de asemenea, foarte strâns legat de un altul, ideea acțiunii capilare.
Acțiunea capilară
Similar cu tensiunea superficială, aceasta se învârte în jurul ideii că moleculele de apă se „lipesc” între ele. Dacă puneți un tub foarte fin într-un pahar cu apă, veți vedea că o parte din apă se deplasează puțin pe tub; aceasta se numește acțiune capilară și este cauzată de apa care se agață de părțile laterale ale tubului și de alte molecule de apă, trăgându-le în sus cu tubul. În cele din urmă, greutatea apei trase este prea mare pentru a fi susținută și apa se oprește din mișcare, ajungând la un echilibru. Același principiu permite plantelor să extragă apă din pământ; pe măsură ce moleculele de apă călătoresc pe tulpină, mai multe molecule de apă se lipesc de ele și se lipesc mai mult de acestea și așa mai departe până când o coloană de apă este transportată în xilem (pentru a afla mai multe despre acest lucru, căutați „transpirația”).
Dar de ce?
Toate aceste proprietăți ale apei sunt esențiale pentru viața așa cum o cunoaștem, dar de ce le are apa? Nici o altă substanță nu face aceste lucruri? Ce este diferit în ceea ce privește apa? Pentru a înțelege răspunsurile la aceste întrebări, trebuie să studiați structura moleculară a apei. Formula chimică pentru apă este H2O, ceea ce înseamnă că conține doi atomi de hidrogen legați covalent de atomul de oxigen, astfel: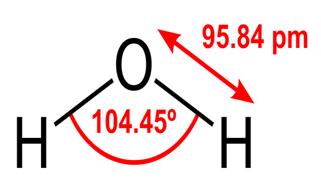
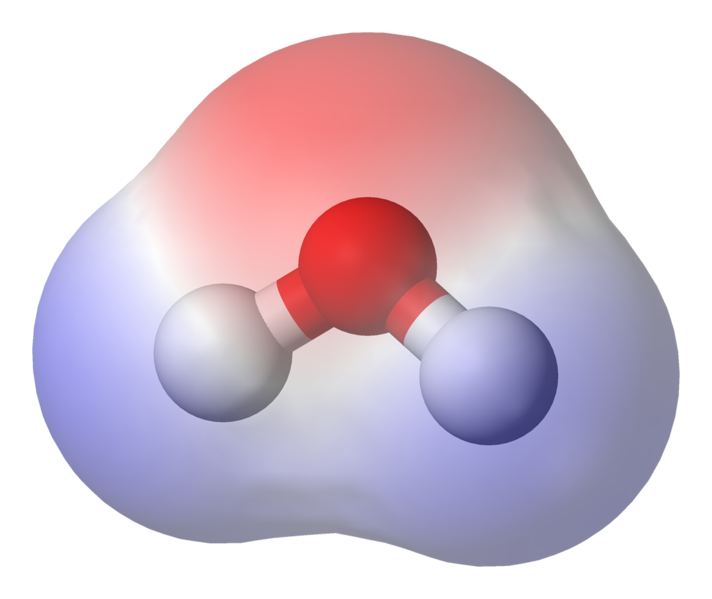
95.84pm arată lungimea legătură între oxigen și hidrogen; ora unu este scurt pentru un picometru, care este o trilionime de metru. Unghiul prezentat este unghiul acut dintre cele două nuclee de hidrogen (aveți idei despre de ce nu este „t $ 180 ^ \ circ $? De ce ar trebui să fie $ 180 ^ \ circ $?) Această diagramă reprezintă legăturile ca linii, care face să pară că sunt la fel în toate punctele? acest lucru nu este cazul. Deoarece oxigenul este mai electronegativ decât hidrogenul atrage electronii din legătura OH către sine. Dacă grosimea liniei reprezintă densitatea electronilor (cantitatea de timp a electronilor cheltuiți în acea parte a legăturii), legătura OH arată de fapt mai mult așa:
IMAGINE care arată polarizarea legăturii
După cum puteți vedea, electronii își petrec cea mai mare parte a timpului mai aproape de nucleul de oxigen. Aceasta înseamnă că oxigenul este ușor încărcat negativ și că hidrogenii sunt puțin încărcați pozitiv. Aceasta se numește polaritate și este conceptul cheie din spatele proprietăților apei
Aceasta înseamnă că interacțiuni ionice slabe pot apărea între n molecule de apă învecinate, deoarece hidrogenul ușor pozitiv dintr-o moleculă este atras de oxigenul ușor negativ de pe alta. Acestea sunt numite legături de hidrogen.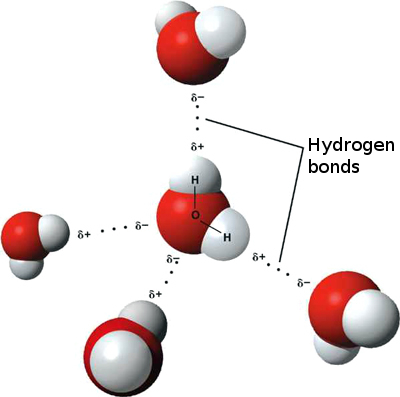
Acesta este motivul pentru care apa se „lipeste” de ea însăși, oferindu-i o tensiune superficială ridicată și capacitatea de a se mișca prin acțiune capilară.
Este necesară o cantitate mare de energie pentru a descompune legăturile de hidrogen, motiv pentru care punctele de topire și fierbere ale apei sunt ridicate și de ce are o capacitate termică specifică ridicată
O substanță se va dizolva în apă dacă este polară sau ionic. Acest lucru se datorează faptului că se dizolvă formând legături de hidrogen cu apa. Uleiul nu este polar, motiv pentru care nu se va dizolva. Sarea, NaCI, se dizolvă deoarece este ionică. Vă puteți gândi la alte substanțe care sunt solubile în apă? Cum formează legături de hidrogen cu acesta? Puteți desena o imagine similară cu cea de mai jos care să arate de ce glucoza este solubilă? Este mai mult sau mai puțin solubil în apă decât sare? De ce credeți că este acest lucru?
O diagramă a ceea ce se întâmplă cu NaCl în soluție:
