Pourquoi les gens disent-ils que l’eau est nécessaire à la vie? Pourquoi n’avons-nous jamais trouvé d’organisme vivant qui puisse s’épanouir dans un environnement complètement sec? Comment se fait-il que quelque chose d’inodore, incolore, insipide et relativement peu réactif représente 60% de notre masse corporelle? Pourquoi un autre liquide ne pourrait-il pas être utilisé? Pourquoi l’eau?
L’eau a plusieurs propriétés qui la rendent unique parmi les composés et permettent à toutes les formes de vie connues de fonctionner.
C’est la seule substance naturelle trouvée dans les trois états physiques aux températures qui se produisent naturellement sur Terre.
Cela signifie que nous voyons l’eau comme un liquide, dans les rivières et les mers, un solide, comme la neige et la glace, et comme un gaz, comme des nuages ou de la vapeur. Si ce n’était pas le cas, le cycle de l’eau serait complètement différent (et si l’eau ne s’évaporait pas au soleil?); La neige et la glace pourraient ne pas exister (et des milliers d’espèces seraient désormais sans abri) et le temps serait très différent ( est-ce qu’il pleuvrait encore?). Pouvez-vous penser à autre chose qui serait différent? Pensez-vous que nous pourrions encore vivre si l’eau n’était qu’un liquide aux températures qui se produisent naturellement sur Terre? Qu’en est-il seulement d’un gaz / solide?
La glace est moins dense que l’eau
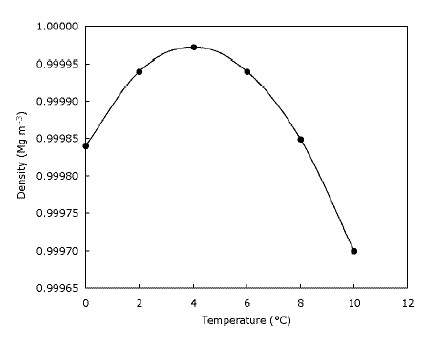
Cela signifie simplement que la glace flotte sur l’eau et que les lacs gèlent de haut en bas. Ceci est clairement important pour les animaux qui vivent sur la glace, car leurs habitats seraient considérablement réduits ou n’existeraient pas du tout si la glace coulait. De même, les poissons et la vie des étangs seraient affectés si les lacs et les étangs gelaient de bas en haut – la couche d’eau gelée au sommet de l’étang fournit une certaine isolation et empêche le reste de l’eau de se refroidir car Il le fait en faisant une barrière entre le froid l’air et l’eau ci-dessous. Cela signifie que de grandes étendues d’eau ne se refroidissent pas aussi vite qu’elles le pourraient si la glace coulait et aide la faune à survivre dans les étangs pendant l’hiver. En fait, l’eau devient plus dense lorsqu’elle est refroidie jusqu’à atteindre 4 $ ^ \ circ $ C (que vous pouvez voir sur le graphique), après quoi elle redevient moins dense. La plupart des substances deviennent progressivement plus denses à mesure qu’elles sont refroidies. Le graphique ci-dessous montre comment la densité de l’eau change avec la température.
L’eau a un point de fusion et d’ébullition très élevé par rapport à d’autres molécules similaires
C’est ce qui signifie qu’elle est considérée comme un solide, un liquide et un gaz sur Terre. Si l’eau n’était pas un liquide à la plupart des températures que nous voyons sur Terre, les mers seraient toutes de la glace, il n’y aurait pas de pluie, rien pour les plantes à collecter et les animaux à boire. Même nos cellules sont remplies d’eau liquide, ce qui ne serait pas possible non plus.
On l’appelle le « solvant universel » car il est capable de dissoudre tant de substances.
L’eau de notre corps i Il est principalement contenu dans nos cellules, où il leur donne une forme claire et contient des milliards de molécules utiles dissoutes. Nos cellules doivent être remplies d’eau pour fonctionner correctement, car les enzymes qu’elles contiennent ne fonctionnent qu’en solution. L’eau est également le moyen par lequel le transport se produit dans notre corps « le sang est principalement de l’eau et a des hormones et des gaz dissous, ainsi que des toxines telles que l’urée, qui sont éliminées du corps avec encore plus d’eau. Le transport dans l’eau se produit également sur un échelle beaucoup plus petite: quand quelque chose est dissous, il peut se déplacer dans le solvant. Par exemple, si une enzyme a besoin d’ions calcium pour être activée et commence à fonctionner, elle les rencontrera au fur et à mesure qu’ils se déplacent dans la solution à l’intérieur d’une cellule. Plus la concentration est élevée de calcium dans la cellule, plus l’enzyme a de chances de rencontrer un ion plus tôt. Vous avez peut-être également appris la diffusion et l’osmose, qui sont des concepts clés pour comprendre le fonctionnement des cellules et dépendent de la présence d’eau
L’eau a un capacité thermique.
Bien que cette idée semble un peu intimidante, elle est en fait très simple – tout ce que cela signifie, c’est qu’il faut beaucoup d’énergie pour rendre l’eau un peu plus chaude. C’est pourquoi, par une journée chaude, le sable sur une plage peut être trop chaud pour marcher mais la mer est toujours fraîche; l’énergie du soleil suffit à chauffer beaucoup le sable mais l’eau seulement un peu. Cela a des implications très importantes, en particulier pour les organismes vivant dans l’eau. Les mers, les lacs et les rivières maintiennent une température beaucoup plus constante que l’air, ce qui signifie que les animaux peuvent vivre dans l’eau toute l’année sans avoir à s’adapter à de grands changements de température (que pensez-vous qu’il se passerait si l’eau se refroidissait plus facilement? pose aux organismes vivant dans un petit étang?). Cela signifie également que la température de notre corps est raisonnablement difficile à changer rapidement et rend donc le travail de notre cerveau de maintenir une température corporelle constante beaucoup plus facile (que pourrait-il se passer si la température de notre corps changeait rapidement et facilement?).
Tension superficielle
Vous avez peut-être remarqué que si vous mettez une aiguille sur la surface d’un bol d’eau, elle flotte mais si vous la jetez dedans, elle coule.C’est parce que l’aiguille est plus dense que l’eau veut donc couler mais qu’elle est maintenue par la tension superficielle de l’eau. La tension superficielle est une propriété qui signifie que la surface de l’eau ne veut pas se casser – elle est « collante ». Vous pouvez également le voir lorsque vous remplissez une tasse à ras bord, car la surface de l’eau tiendra ensemble et résiste à tout renversement. La tension superficielle élevée de l’eau est la raison pour laquelle certaines mouches peuvent atterrir à sa surface sans couler. Ce concept est également très étroitement lié à un autre, l’idée de l’action capillaire.
Action capillaire
De même pour la tension superficielle, cela tourne autour de l’idée que les molécules d’eau « collent » ensemble. Si vous mettez un tube très fin dans un bécher d’eau, vous verrez qu’une partie de l’eau se déplace un peu plus haut dans le tube; cela s’appelle l’action capillaire et est causé par l’eau qui s’accroche aux côtés du tube et à d’autres molécules d’eau, les tirant vers le haut du tube avec elle. Finalement, le poids de l’eau tirée est trop important pour être supporté et l’eau cesse de bouger, ayant atteint un équilibre. Ce même principe permet aux plantes de puiser l’eau du sol; au fur et à mesure que les molécules d’eau remontent la tige, plus de molécules d’eau y adhèrent et plus adhèrent à celles-ci et ainsi de suite jusqu’à ce qu’une colonne d’eau soit transportée dans le xylème (pour en savoir plus, recherchez «transpiration»).
Mais pourquoi?
Toutes ces propriétés de l’eau sont essentielles à la vie telle que nous la connaissons, mais pourquoi l’eau en a-t-elle? Aucune autre substance ne fait aussi ces choses? Qu’est-ce qui rend l’eau différente? Pour comprendre les réponses à ces questions, vous devez étudier la structure moléculaire de l’eau. La formule chimique de l’eau est H2O, ce qui signifie qu’elle contient deux atomes d’hydrogène liés de manière covalente à un atome d’oxygène, comme ceci: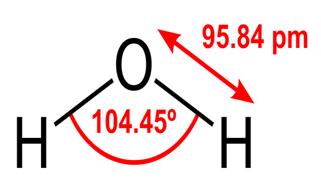
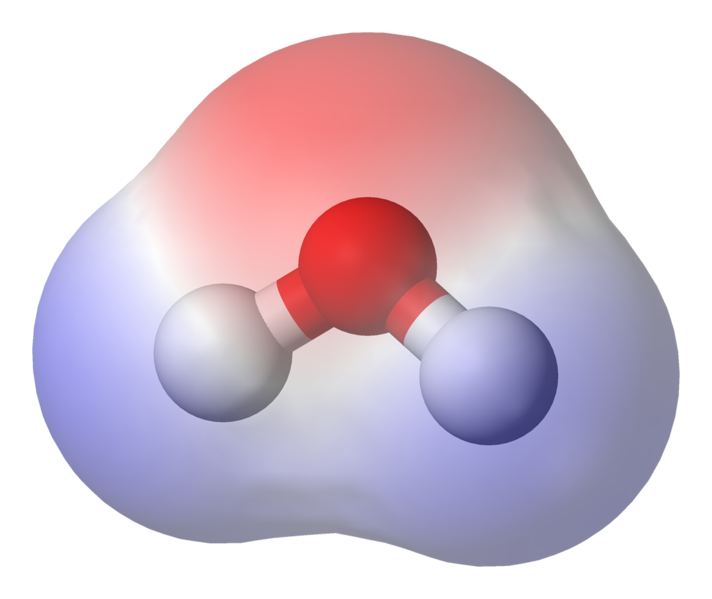
Le 95.84pm indique la longueur du liaison entre l’oxygène et l’hydrogène; une heure de l’après-midi correspond à un picomètre, soit un billionième de mètre. L’angle indiqué est l’angle aigu entre les deux noyaux d’hydrogène (avez-vous une idée de pourquoi il n’est pas « t $ 180 ^ \ circ $? Pourquoi devrait-il être de 180 $ ^ \ circ $?) Ce diagramme représente les liaisons sous forme de lignes, qui ce n’est pas le cas. Parce que l’oxygène est plus électronégatif que l’hydrogène, il attire les électrons de la liaison OH vers lui-même. Si l’épaisseur de la ligne représente la densité électronique (la quantité de temps électrons passer dans cette partie de la liaison), la liaison OH ressemble plus à ceci:
IMAGE montrant la polarisation de la liaison
Comme vous pouvez le voir, les électrons passent la plupart de leur temps plus près du noyau oxygène. l’oxygène est légèrement chargé négativement et que les hydrogènes sont légèrement chargés positivement. C’est ce qu’on appelle la polarité et c’est le concept clé derrière les propriétés de l’eau
Cela signifie que de faibles interactions ioniques peuvent se produire entre n Les molécules d’eau voisines, car l’hydrogène légèrement positif d’une molécule est attiré par l’oxygène légèrement négatif d’une autre. Celles-ci sont appelées liaisons hydrogène.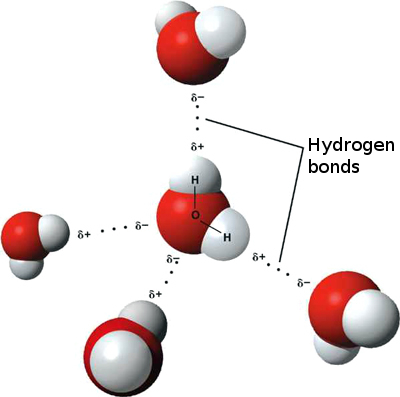
C’est pourquoi l’eau « colle » à elle-même, ce qui lui confère une tension superficielle élevée et la capacité de se déplacer par capillarité.
Une grande quantité d’énergie est nécessaire pour briser les liaisons hydrogène, c’est pourquoi les points de fusion et d’ébullition de l’eau sont élevés et pourquoi elle a une capacité thermique spécifique élevée
Une substance se dissoudra dans l’eau si elle est polaire ou ionique. C’est parce qu’il se dissout en formant des liaisons hydrogène avec l’eau. L’huile n’est pas polaire, c’est pourquoi elle ne se dissout pas. Le sel, NaCl, se dissout parce qu’il est ionique. Pouvez-vous penser à d’autres substances solubles dans l’eau? Comment forment-ils des liaisons hydrogène avec lui? Pouvez-vous dessiner une image similaire à celle ci-dessous montrant pourquoi le glucose est soluble? Est-il plus ou moins soluble dans l’eau que le sel? Pourquoi pensez-vous que c’est?
Un diagramme de ce qui arrive au NaCl en solution:
