Flash info
Le bulletin d’information interrompt votre programme TV préféré. « Il y a eu un hold-up à la First National Bank. Le suspect s’est enfui dans une voiture et on pense qu’il se trouve quelque part dans le quartier du centre-ville. On demande à tout le monde d’être sur le qui-vive. » Le voleur ne peut être localisé que dans une certaine zone – la police n’a pas de localisation exacte, juste une idée générale de l’endroit où se trouve le voleur.
En 1926, Le physicien autrichien Erwin Schrödinger (1887–1961) a utilisé la dualité onde-particule de l’électron pour développer et résoudre une équation mathématique complexe décrivant avec précision le comportement de l’électron dans un atome d’hydrogène. Le modèle de mécanique quantique de l’atome provient de la solution. à l’équation de Schrödinger. La quantification des énergies électroniques est une exigence pour résoudre l’équation. Ceci est différent du modèle de Bohr, dans lequel la quantification était simplement supposée sans base mathématique.
Rappelez-vous que dans le modèle de Bohr, le trajet exact de l’électron était limité à des orbites circulaires très bien définies autour du noyau. Le modèle de mécanique quantique est un changement radical par rapport à cela. en un point donné autour du noyau. Les électrons ne se déplacent pas autour du noyau sur de simples orbites circulaires.
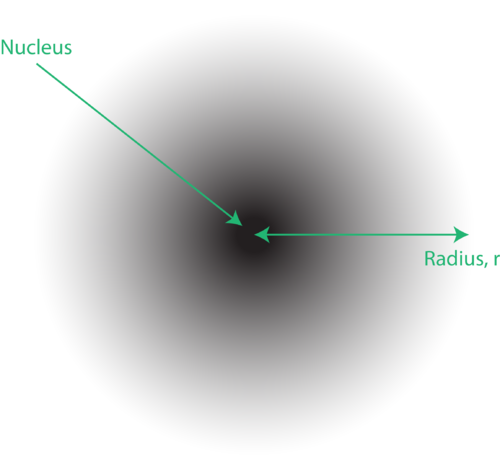
Figure 1. Un nuage d’électrons: la région la plus sombre la plus proche du noyau indique une forte probabilité de trouver l’électron, tandis que la région plus claire plus éloignée du noyau indique une probabilité plus faible de trouver l’électron.
L’emplacement des électrons dans le modèle de mécanique quantique de l’atome est souvent appelé nuage d’électrons. Le nuage d’électrons peut être pensé de la manière suivante: Imaginez placer un morceau de papier carré sur le sol avec un point dans le cercle représentant le noyau. Maintenant, prenez un marqueur et déposez-le sur le papier à plusieurs reprises, en faisant de petites marques à chaque point frappé par le marqueur. Si vous déposez le marqueur de nombreuses fois, le motif général des points sera à peu près circulaire. Si vous visez raisonnablement bien vers le centre, il y aura plus de points près du noyau et progressivement moins de points à mesure que vous vous en éloignez. Chaque point représente un emplacement où l’électron pourrait se trouver à un moment donné. En raison du principe d’incertitude, il n’y a aucun moyen de savoir exactement où se trouve l’électron. Un nuage d’électrons a des densités variables: une densité élevée là où l’électron est le plus susceptible d’être et une densité faible là où l’électron est le moins susceptible d’être (Figure 1).
Afin de définir spécifiquement la forme de le nuage, il est d’usage de se référer à la région de l’espace dans laquelle il y a une probabilité de 90% de trouver l’électron. C’est ce qu’on appelle une orbitale, la région tridimensionnelle de l’espace qui indique où il y a une forte probabilité de trouver un électron.
Résumé
- L’onde de Schrödinger L’équation a remplacé les idées de Bohr sur la localisation des électrons par un facteur d’incertitude.
- La localisation de l’électron ne peut être donnée que comme une probabilité que l’électron se trouve quelque part dans une certaine zone.
Pratique
Utilisez le lien ci-dessous pour répondre aux questions suivantes:
http://science.howstuffworks.com/atom8.htm
- Quel était le problème avec le modèle de Bohr de l’atome?
- Qu’a montré Heisenberg sur les électrons?
- Qu’est-ce que Schrödinger a dérivé?
Révision
- De quoi a besoin la vue mécanique quantique de l’atome?
- Qu’est-ce qu’une fonction d’onde?
- Que suggère un nuage d’électrons à haute densité?
Glossaire
- nuage d’électrons: l’emplacement du électrons dans le modèle de mécanique quantique de l’atome.
- orbitale: la région tridimensionnelle de l’espace qui indique où il y a une forte probabilité de trouver un électron.
- modèle de mécanique quantique: un modèle de l’atome qui dérive de l’équation d’onde de Schrödinger et traite des probabilités.
- fonction d’onde: donne seulement la probabilité de trouver un électron en un point donné autour du noyau.
