ニュースフラッシュ
ニュースフラッシュはお気に入りのテレビ番組を中断します。 「第一国立銀行で停滞があった。容疑者は車で逃げ、繁華街のどこかにいると信じられている。誰もが警戒するよう求められている。」強盗は特定のエリア内にのみ配置できます。警察は正確な場所を把握しておらず、泥棒の所在に関する一般的な考えを持っています。
1926年、オーストリアの物理学者ErwinSchrödinger(1887–1961)は、電子の波動粒子の二重性を使用して、水素原子内の電子の振る舞いを正確に表す複雑な数式を作成して解きました。原子の量子力学的モデルは、解から得られます。シュレーディンガーの方程式に。方程式を解くには、電子エネルギーの量子化が必要です。これは、量子化が数学的な根拠なしに単純に仮定されたボーアモデルとは異なります。
ボーアモデルでは、電子の正確な経路は、核の周りの非常に明確に定義された円形軌道に制限されていました。量子機械モデルは、それからの根本的な逸脱です。波動関数と呼ばれるシュレーディンガー波動方程式の解は、電子を見つける確率のみを示します。核の周りの特定のポイントで。電子は単純な円軌道で原子核の周りを移動しません。
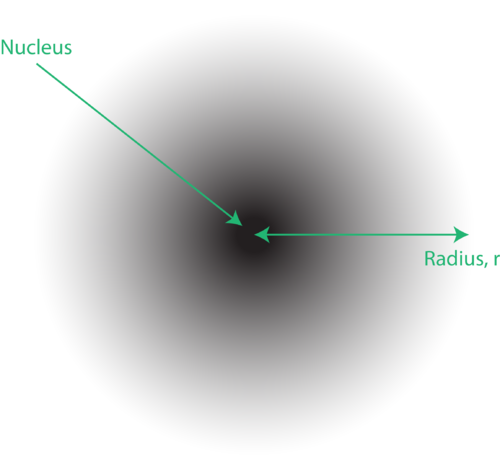
図1。電子雲:原子核に近い暗い領域は電子を見つける可能性が高いことを示し、原子核から遠い明るい領域は電子を見つける可能性が低いことを示します。
原子の量子機械モデルにおける電子の位置は、しばしば電子雲と呼ばれます。電子雲は次のように考えることができます。原子核を表す円の中に点がある正方形の紙を床に置くことを想像してみてください。次に、マーカーを取り、それを紙に繰り返しドロップし、マーカーが当たる各ポイントに小さなマークを付けます。マーカーを何度もドロップすると、ドットの全体的なパターンはほぼ円形になります。中心を適度に狙うと、核の近くのドットが多くなり、核から離れるにつれてドットが徐々に少なくなります。各ドットは、電子が任意の瞬間に存在する可能性のある場所を表します。不確定性原理のため、電子がどこにあるかを正確に知る方法はありません。電子雲の密度はさまざまです。電子が存在する可能性が最も高い高密度と、電子が存在する可能性が最も低い低密度です(図1)。
の形状を具体的に定義するため雲の場合、電子を見つける確率が90%である空間の領域を参照するのが通例です。これは軌道と呼ばれ、電子を見つける可能性が高い場所を示す空間の3次元領域です。
要約
- シュレディンガー波方程式は、電子の位置に関するボーアの考えを不確実係数に置き換えました。
- 電子の位置は、電子が特定の領域のどこかにある確率としてのみ指定できます。
練習
以下のリンクを使用して、次の質問に答えてください。
http://science.howstuffworks.com/atom8.htm
- 原子のボーアモデルの1つの問題は何でしたか?
- ハイゼンベルグは電子について何を示しましたか?
- シュレーディンガーは何を導き出しましたか?
レビュー
- 原子の量子力学的ビューには何が必要ですか?
- 波動関数とは何ですか?
- 高密度電子雲は何を示唆していますか?
用語集
- 電子雲:の電子原子の量子機械モデル。
- 軌道:電子を見つける可能性が高い場所を示す空間の3次元領域。
- 量子機械モデル:のモデルSchrödinger波動方程式から導出され、確率を扱う原子。
- 波動関数:原子核の周りの特定の点で電子を見つける確率のみを与えます。
