Kurznachrichten
Die Kurznachrichten unterbrechen Ihr Lieblingsfernsehprogramm. „Bei der First National Bank gab es einen Überfall. Der Verdächtige ist in einem Auto geflohen und befindet sich vermutlich irgendwo in der Innenstadt. Jeder wird gebeten, auf der Hut zu sein.“ Der Räuber kann nur in einem bestimmten Gebiet lokalisiert werden – die Polizei hat keinen genauen Ort, nur eine allgemeine Vorstellung vom Aufenthaltsort des Diebes.
1926, Der österreichische Physiker Erwin Schrödinger (1887–1961) verwendete die Welle-Teilchen-Dualität des Elektrons, um eine komplexe mathematische Gleichung zu entwickeln und zu lösen, die das Verhalten des Elektrons in einem Wasserstoffatom genau beschreibt. Das quantenmechanische Modell des Atoms stammt aus der Lösung nach Schrödingers Gleichung: Die Quantisierung von Elektronenenergien ist eine Voraussetzung, um die Gleichung zu lösen. Dies ist anders als beim Bohr-Modell, bei dem die Quantisierung einfach ohne mathematische Grundlage angenommen wurde.
Erinnern Sie sich daran, dass im Bohr-Modell Der genaue Weg des Elektrons war auf sehr genau definierte Kreisbahnen um den Kern beschränkt. Das quantenmechanische Modell ist eine radikale Abweichung davon. Lösungen der Schrödinger-Wellengleichung, Wellenfunktionen genannt, geben nur die Wahrscheinlichkeit, ein Elektron zu finden an einem bestimmten Punkt um den Kern. Elektronen bewegen sich nicht in einfachen Kreisbahnen um den Kern.
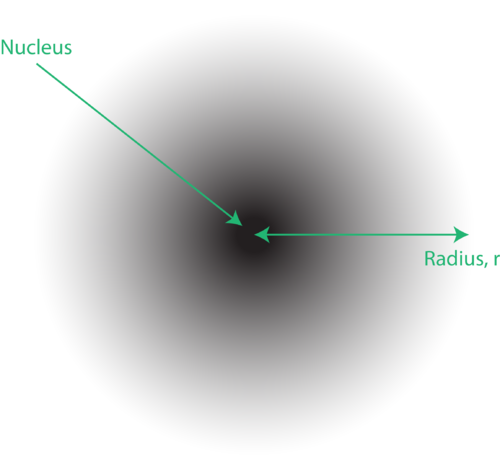
Abbildung 1. An Elektronenwolke: Der dunklere Bereich näher am Kern zeigt eine hohe Wahrscheinlichkeit an, das Elektron zu finden, während der hellere Bereich weiter vom Kern eine geringere Wahrscheinlichkeit anzeigt, das Elektron zu finden.
Der Ort der Elektronen im quantenmechanischen Modell des Atoms wird oft als Elektronenwolke bezeichnet. Die Elektronenwolke kann folgendermaßen betrachtet werden: Stellen Sie sich vor, Sie legen ein quadratisches Stück Papier mit einem Punkt im Kreis, der den Kern darstellt, auf den Boden. Nehmen Sie nun einen Marker und lassen Sie ihn wiederholt auf das Papier fallen. Machen Sie an jedem Punkt, an dem der Marker trifft, kleine Markierungen. Wenn Sie den Marker viele Male fallen lassen, ist das Gesamtmuster der Punkte ungefähr kreisförmig. Wenn Sie einigermaßen gut auf das Zentrum zielen, gibt es mehr Punkte in der Nähe des Kerns und zunehmend weniger Punkte, wenn Sie sich von diesem entfernen. Jeder Punkt repräsentiert einen Ort, an dem sich das Elektron zu einem bestimmten Zeitpunkt befinden könnte. Aufgrund des Unsicherheitsprinzips gibt es keine Möglichkeit, genau zu wissen, wo sich das Elektron befindet. Eine Elektronenwolke hat variable Dichten: eine hohe Dichte, bei der das Elektron am wahrscheinlichsten ist, und eine niedrige Dichte, bei der das Elektron am wenigsten wahrscheinlich ist (Abbildung 1).
Um die Form von spezifisch zu definieren In der Wolke ist es üblich, sich auf den Raumbereich zu beziehen, in dem eine Wahrscheinlichkeit von 90% besteht, das Elektron zu finden. Dies wird als Orbital bezeichnet, der dreidimensionale Raumbereich, der angibt, wo mit hoher Wahrscheinlichkeit ein Elektron gefunden wird.
Zusammenfassung
- Die Schrödinger-Welle Die Gleichung ersetzte die Bohr-Vorstellungen über den Elektronenort durch einen Unsicherheitsfaktor.
- Der Ort des Elektrons kann nur als Wahrscheinlichkeit angegeben werden, dass sich das Elektron irgendwo in einem bestimmten Bereich befindet.
Übung
Beantworten Sie über den folgenden Link die folgenden Fragen:
http://science.howstuffworks.com/atom8.htm
- Was war ein Problem mit dem Bohr-Modell des Atoms?
- Was zeigte Heisenberg über Elektronen?
- Was hat Schrödinger abgeleitet?
Review
- Was erfordert die quantenmechanische Ansicht des Atoms?
- Was ist eine Wellenfunktion?
- Was schlägt eine Elektronenwolke mit hoher Dichte vor?
Glossar
- Elektronenwolke: Der Ort der Elektronen in der quantenmechanisches Modell des Atoms.
- Orbital: Der dreidimensionale Raumbereich, der angibt, wo eine hohe Wahrscheinlichkeit besteht, ein Elektron zu finden.
- quantenmechanisches Modell: Ein Modell von das Atom, das sich aus der Schrödinger-Wellengleichung ableitet und sich mit Wahrscheinlichkeiten befasst.
- Wellenfunktion: Geben Sie nur die Wahrscheinlichkeit an, ein Elektron an einem bestimmten Punkt um den Kern herum zu finden.
