Newsflash
Newsflash keskeyttää suosikki TV-ohjelmasi. ”Ensimmäisessä kansallisessa pankissa on ollut pidätys. Epäilty pakeni autolla ja uskotaan olevan jonnekin keskustan alueella. Kaikkia pyydetään olemaan hälytys.” Ryöstö voi sijaita vain tietyllä alueella – poliisilla ei ole tarkkaa sijaintia, vain yleinen käsitys varkaan olinpaikasta.
Vuonna 1926 Itävaltalainen fyysikko Erwin Schrödinger (1887–1961) kehitti ja ratkaisi kompleksin matemaattisen yhtälön, joka kuvaa elektronin käyttäytymistä vetyatomissa, elektronin aaltopartikkelidualiteetin avulla. Atomin kvanttimekaaninen malli tulee ratkaisusta Schrödingerin yhtälöön. Elektronienergioiden kvantisointi on vaatimus yhtälön ratkaisemiseksi. Tämä eroaa Bohr-mallista, jossa kvantisointi yksinkertaisesti oletettiin ilman matemaattista perustaa.
Muistakaa, että Bohr-mallissa elektronin tarkka polku rajoitettiin hyvin tarkkaan määriteltyihin ympyrän kiertoradoihin ytimen ympärillä.Kvanttimekaaninen malli on radikaali poikkeama siitä.Ratkaisut Schrödingerin aaltoyhtälöön, nimeltään aaltofunktiot, antavat vain todennäköisyyden löytää elektroni tietyssä pisteessä ytimen ympärillä. Elektronit eivät kulje ytimen ympäri yksinkertaisilla pyöreillä kiertoradoilla.
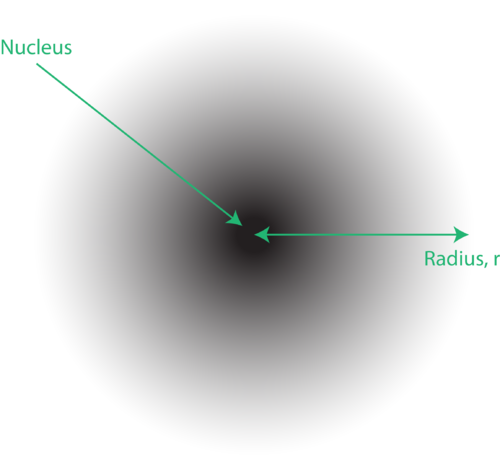
Kuva 1. An elektronipilvi: tummempi alue lähempänä ydintä osoittaa suuren todennäköisyyden löytää elektroni, kun taas vaaleampi alue ytimestä osoittaa pienemmän todennäköisyyden löytää elektroni.
Elektronien sijaintia atomin kvanttimekaanisessa mallissa kutsutaan usein elektronipilveksi. Elektronipilvi voidaan ajatella seuraavalla tavalla: Kuvittele, että asetat neliönmuotoisen paperin lattialle ja piste ympyrää edustavassa ytimessä. Ota nyt merkki ja pudota se paperille toistuvasti ja tee pienet merkinnät jokaiseen pisteeseen, johon merkki osuu. Jos pudotat merkin monta kertaa, pisteiden yleiskuvio on suunnilleen pyöreä. Jos tähdät kohti keskustaa kohtuullisen hyvin, ytimen lähellä on enemmän pisteitä ja vähitellen vähemmän pisteitä, kun siirryt siitä pois. Jokainen piste edustaa paikkaa, jossa elektroni voisi olla milloin tahansa. Epävarmuusperiaatteen takia ei ole mitään keinoa tietää tarkalleen missä elektroni on. Elektronipilvellä on vaihteleva tiheys: suuri tiheys, jossa elektroni on todennäköisimmin, ja pieni tiheys, jossa elektroni on todennäköisesti (Kuva 1).
Määritelläksesi tarkasti pilvessä, on tapana viitata avaruusalueeseen, jolla on 90 prosentin todennäköisyys löytää elektroni. Tätä kutsutaan kiertoradaksi, kolmiulotteiseksi avaruusalueeksi, joka osoittaa, missä on suuri todennäköisyys löytää elektroni.
Yhteenveto
- Schrödinger-aalto yhtälö korvasi Bohrin ajatukset elektronien sijainnista epävarmuustekijällä.
- Elektronin sijainti voidaan antaa vain todennäköisenä, että elektroni on jossain tietyllä alueella.
Harjoittele
Käytä alla olevaa linkkiä vastaamaan seuraaviin kysymyksiin:
http://science.howstuffworks.com/atom8.htm
- Mikä oli yksi ongelma Bohrin atomimallissa?
- Mitä Heisenberg näytti elektroneista?
- Mitä Schrödinger johti?
Katsaus
- Mitä atomin kvanttimekaaninen näkymä vaatii?
- Mikä on aaltofunktio?
- Mitä suurtiheyksinen elektronipilvi ehdottaa?
Sanasto
- elektronipilvi: elektronit kvanttimekaaninen malli atomista.
- kiertorata: Avaruuden kolmiulotteinen alue, joka osoittaa, missä on suuri todennäköisyys löytää elektroni.
- kvanttimekaaninen malli: malli Schrödingerin aaltoyhtälöstä johdettu ja todennäköisyyksiä käsittelevä atomi.
- aaltofunktio: Anna vain todennäköisyys löytää elektroni tietystä pisteestä ytimen ympäriltä.
