Newsflash
Il newsflash interrompe il tuo programma TV preferito. “C’è stata una rapina alla First National Bank. Il sospetto è fuggito in macchina e si crede che si trovi da qualche parte nel distretto del centro. A tutti viene chiesto di stare in allerta”. Il ladro può essere localizzato solo all’interno di una determinata area: la polizia non ha una posizione esatta, ma solo un’idea generale del luogo in cui si trova il ladro.
Nel 1926, Il fisico austriaco Erwin Schrödinger (1887-1961) usò la dualità onda-particella dell’elettrone per sviluppare e risolvere una complessa equazione matematica che descriveva accuratamente il comportamento dell’elettrone in un atomo di idrogeno. Il modello quantistico dell’atomo deriva dalla soluzione all’equazione di Schrödinger. La quantizzazione delle energie degli elettroni è un requisito per risolvere l’equazione. Questo è diverso dal modello di Bohr, in cui la quantizzazione era semplicemente assunta senza basi matematiche.
Ricorda che nel modello di Bohr, il percorso esatto dell’elettrone era limitato a orbite circolari ben definite attorno al nucleo. Il modello della meccanica quantistica è un cambiamento radicale da quello. Le soluzioni dell’equazione d’onda di Schrödinger, chiamate funzioni d’onda, danno solo la probabilità di trovare un elettrone in un dato punto attorno al nucleo. Gli elettroni non viaggiano intorno al nucleo in semplici orbite circolari.
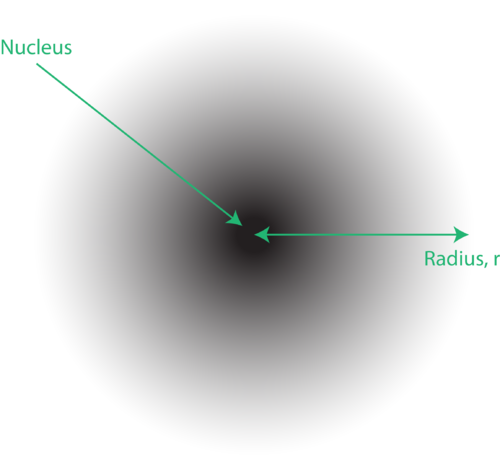
Figura 1. An nuvola di elettroni: la regione più scura più vicina al nucleo indica un’alta probabilità di trovare l’elettrone, mentre la regione più chiara più lontana dal nucleo indica una minore probabilità di trovare l’elettrone.
La posizione degli elettroni nel modello quantistico dell’atomo viene spesso definita nuvola di elettroni. La nuvola di elettroni può essere pensata nel modo seguente: Immagina di posizionare un pezzo di carta quadrato sul pavimento con un punto nel cerchio che rappresenta il nucleo. Ora prendi un pennarello e lascialo cadere ripetutamente sulla carta, facendo piccoli segni in ogni punto in cui il pennarello colpisce. Se rilasci il pennarello molte, molte volte, il motivo complessivo dei punti sarà approssimativamente circolare. Se miri verso il centro ragionevolmente bene, ci saranno più punti vicino al nucleo e progressivamente meno punti man mano che ti allontani da esso. Ogni punto rappresenta una posizione in cui l’elettrone potrebbe trovarsi in un dato momento. A causa del principio di indeterminazione, non c’è modo di sapere esattamente dove si trova l’elettrone. Una nuvola di elettroni ha densità variabili: un’alta densità dove è più probabile che si trovi l’elettrone e una densità bassa dove è meno probabile che si trovi l’elettrone (Figura 1).
Per definire in modo specifico la forma di la nuvola, è consuetudine riferirsi alla regione dello spazio all’interno della quale c’è una probabilità del 90% di trovare l’elettrone. Questo è chiamato orbitale, la regione tridimensionale dello spazio che indica dove c’è un’alta probabilità di trovare un elettrone.
Riepilogo
- L’onda di Schrödinger l’equazione ha sostituito le idee di Bohr sulla posizione dell’elettrone con un fattore di incertezza.
- La posizione dell’elettrone può essere data solo come una probabilità che l’elettrone si trovi da qualche parte in una certa area.
Esercitazione
Utilizza il link sottostante per rispondere alle seguenti domande:
http://science.howstuffworks.com/atom8.htm
- Qual era un problema con il modello di Bohr dell’atomo?
- Cosa mostrava Heisenberg degli elettroni?
- Cosa ne ricavava Schrödinger?
Recensione
- Cosa richiede la visione quantistica dell’atomo?
- Cos’è una funzione d’onda?
- Cosa suggerisce una nuvola di elettroni ad alta densità?
Glossario
- nuvola di elettroni: la posizione del elettroni in modello meccanico quantistico dell’atomo.
- orbitale: la regione tridimensionale dello spazio che indica dove c’è un’alta probabilità di trovare un elettrone.
- modello meccanico quantistico: un modello di l’atomo che deriva dall’equazione d’onda di Schrödinger e si occupa delle probabilità.
- funzione d’onda: fornisce solo la probabilità di trovare un elettrone in un dato punto attorno al nucleo.
