Newsflash
A newsflash megszakítja kedvenc TV-műsorát. “Volt egy visszatartás az Első Nemzeti Banknál. A gyanúsított autóval menekült, és vélhetően valahol a belvárosi kerületben tartózkodik. Mindenkit arra kérnek, hogy legyen készenlétben.” A rabló csak egy bizonyos területen található – a rendőrségnek nincs pontos tartózkodási helye, csupán egy általános elképzelés a tolvaj tartózkodási helyéről.
1926-ban Erwin Schrödinger (1887–1961) osztrák fizikus az elektron hullám-részecske kettősségét felhasználva kifejlesztett és megoldott egy komplex matematikai egyenletet, amely pontosan leírta az elektron viselkedését egy hidrogénatomban. Az atom kvantummechanikai modellje a megoldásból származik Schrödinger egyenletéhez. Az egyenlet megoldásához követelmény az elektronenergia kvantálása. Ez ellentétben áll a Bohr-modellel, amelyben a kvantálást egyszerűen matematikai alap nélkül feltételezték.
Emlékezzünk vissza, hogy a Bohr-modellben az elektron pontos útja a mag körül nagyon jól körülhatárolható körpályákra korlátozódott. A kvantummechanikai modell ettől gyökeresen eltér. A Schrödinger-féle hullámegyenlet megoldások, az úgynevezett hullámfüggvények, csak az elektron megtalálásának valószínűségét adják meg. a mag körül adott ponton. Az elektronok nem körkörös keringésben keringenek a sejtmag körül.
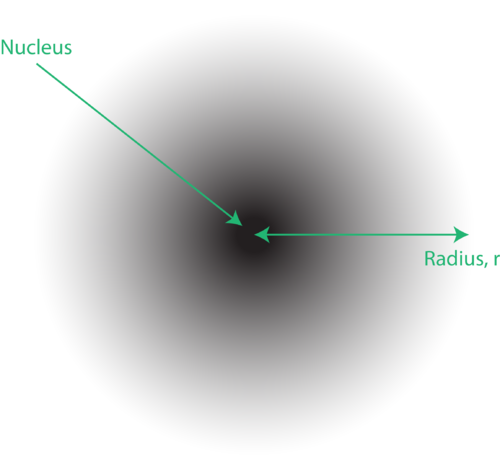
1. ábra elektronfelhő: a maghoz közelebb eső sötétebb régió az elektron megtalálásának nagy valószínűségét jelzi, míg a magtól távolabb eső világosabb régió az elektron megtalálásának kisebb valószínűségét jelzi.
Az elektronok helyét az atom kvantummechanikai modelljében gyakran elektronfelhőnek nevezik. Az elektronfelhőt a következőképpen lehet elképzelni: Képzelje el, hogy egy négyzet alakú papírdarabot helyez el a padlón, a magot ábrázoló körben egy pont található. Most vegyen egy jelölőt, és ismételten dobja rá a papírra, apró jeleket téve a jelölő minden pontján. Ha sokszor, sokszor elejtjük a jelzőt, a pontok általános mintázata nagyjából kör alakú lesz. Ha viszonylag jól a középpont felé céloz, akkor több pont lesz a mag közelében és fokozatosan kevesebb pont lesz, ahogy eltávolodik tőle. Minden pont egy helyet jelöl, ahol az elektron bármely pillanatban tartózkodhat. A bizonytalansági elv miatt nincs mód pontosan tudni, hogy hol van az elektron. Az elektronfelhő sűrűsége változó: nagy sűrűségű, ahol az elektron a legvalószínűbb, és alacsony sűrűségű, ahol az elektron a legkevésbé valószínű (1. ábra).
A a felhő, szokás utalni arra a térrészre, amelyen belül az elektron megtalálásának 90% -os valószínűsége van. Ezt orbitálisnak nevezzük, a tér háromdimenziós régiójának, amely jelzi, hol van nagy valószínűséggel egy elektron.
Összefoglaló
- A Schrödinger-hullám egyenlet bizonytalansági tényezővel váltotta fel az elektronok elhelyezéséről szóló Bohr-elképzeléseket.
- Az elektron helyét csak annak valószínűségeként adhatjuk meg, hogy az elektron valahol egy bizonyos területen van.
Gyakorlat
Az alábbi link használatával válaszoljon a következő kérdésekre:
http://science.howstuffworks.com/atom8.htm
- Mi volt az egyik probléma az atom Bohr-modelljével?
- Mit mutatott Heisenberg az elektronokról?
- Mit vezetett le Schrödinger?
Áttekintés
- Mit igényel az atom kvantummechanikai nézete?
- Mi a hullámfüggvény?
- Mit sugall a nagy sűrűségű elektronfelhő?
Szószedet
- elektronfelhő: A elektronok a az atom kvantummechanikai modellje.
- orbitális: A tér háromdimenziós régiója, amely jelzi, hol van nagy valószínűséggel elektront találni.
- kvantummechanikai modell: A az az atom, amely a Schrödinger-hullámegyenletből származik és valószínűségekkel foglalkozik.
- hullámfüggvény: Csak annak a valószínűségét adja meg, hogy az atom körül egy adott pontban megtalálható egy elektron.
