뉴스 플래시
뉴스 플래시는 좋아하는 TV 프로그램을 방해합니다. “제 1 국립 은행이 지연 됐습니다. 용의자는 차를 타고 도주 해 도심 어딘가에있는 것으로 추정됩니다. 모든 사람이 경계를하도록 요청 받았습니다.” 강도는 특정 지역에만 위치 할 수 있습니다. 경찰은 정확한 위치를 알지 못하며 도둑의 소재에 대한 일반적인 아이디어 만 가지고 있습니다.
1926 년, 오스트리아의 물리학 자 Erwin Schrödinger (1887–1961)는 전자의 파동 입자 이중성을 사용하여 수소 원자에서 전자의 거동을 정확하게 설명하는 복잡한 수학 방정식을 개발하고 해결했습니다. 원자의 양자 역학적 모델은 솔루션에서 비롯됩니다. 전자 에너지의 양자화는 방정식을 풀기위한 필수 조건입니다. 이것은 양자화가 수학적 근거없이 단순히 가정 된 Bohr 모델과 다릅니다.
Bohr 모델에서, 전자의 정확한 경로는 핵 주변의 매우 잘 정의 된 원형 궤도로 제한되었습니다. 양자 역학 모델은 그것에서 급진적 인 이탈입니다. 파동 함수라고하는 슈뢰딩거 파동 방정식의 해는 전자를 찾을 확률 만 제공합니다. 핵 주변의 주어진 지점에서. 전자는 단순한 원형 궤도로 핵 주위를 이동하지 않습니다.
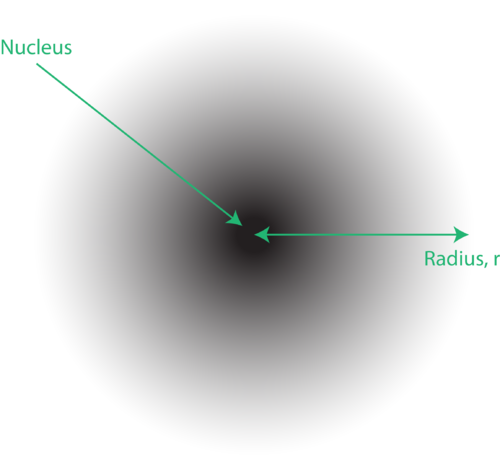
그림 1. An 전자 구름 : 핵에 가까울수록 전자를 찾을 확률이 높고 핵에서 멀어 질수록 전자를 찾을 확률이 낮습니다.
원자의 양자 역학적 모델에서 전자의 위치를 종종 전자 구름이라고합니다. 전자 구름은 다음과 같은 방식으로 생각할 수 있습니다. 핵을 나타내는 원 안에 점이있는 사각형 종이를 바닥에 놓는다 고 상상해보십시오. 이제 마커를 가져다가 종이에 반복적으로 떨어 뜨리고 마커가 부딪히는 각 지점에 작은 표시를합니다. 마커를 여러 번 떨어 뜨리면 점의 전체 패턴이 대략 원형이됩니다. 중앙을 합리적으로 잘 조준하면 핵 근처에 더 많은 점이 생기고 핵에서 멀어 질수록 점진적으로 더 적은 점이 생깁니다. 각 점은 주어진 순간에 전자가있을 수있는 위치를 나타냅니다. 불확실성 원리 때문에 전자가 어디에 있는지 정확히 알 수있는 방법이 없습니다. 전자 구름은 밀도가 가변적입니다. 전자가있을 가능성이 가장 높은 고밀도와 전자가있을 가능성이 가장 적은 저밀도입니다 (그림 1).
의 형태를 구체적으로 정의하기 위해 전자를 찾을 확률이 90 % 인 공간 영역을 나타내는 것이 일반적입니다. 이것은 전자를 찾을 확률이 높은 곳을 나타내는 3 차원 공간 영역 인 궤도라고합니다.
요약
- 슈뢰딩거 파동 방정식은 전자 위치에 대한 Bohr의 아이디어를 불확실성 요인으로 대체했습니다.
- 전자의 위치는 전자가 특정 영역에있을 확률로만 주어질 수 있습니다.
연습
아래 링크를 사용하여 다음 질문에 답하십시오.
http://science.howstuffworks.com/atom8.htm
- 원자의 보어 모델에서 한 가지 문제는 무엇 이었습니까?
- 하이젠 베르크는 전자에 대해 무엇을 보여 주었습니까?
- 슈뢰딩거는 무엇을 유도 했습니까?
검토
- 원자의 양자 역학적 관점에 필요한 것은 무엇입니까?
- 파동 함수 란 무엇입니까?
- 고밀도 전자 구름은 무엇을 암시합니까?
용어집
- 전자 구름 : 전자는 원자의 양자 역학 모델.
- 궤도 : 전자를 찾을 확률이 높은 위치를 나타내는 3 차원 공간 영역
- 양자 역학 모델 : 모델 Schrödinger 파동 방정식에서 파생되고 확률을 다루는 원자
- 파동 함수 : 핵 주변의 특정 지점에서 전자를 찾을 확률 만 제공합니다.
