Nyhetsflöde
Nyhetsflödet avbryter ditt favorit-TV-program. ”Det har varit ett uppehåll vid First National Bank. Den misstänkte flydde i en bil och tros vara någonstans i centrala distriktet. Alla uppmanas att vara på vakt.” Rånaren kan bara lokaliseras inom ett visst område – polisen har ingen exakt plats, bara en allmän uppfattning om var tjuven befinner sig.
1926, Den österrikiska fysikern Erwin Schrödinger (1887–1961) använde elektronens vågpartikel dualitet för att utveckla och lösa en komplex matematisk ekvation som exakt beskrev elektronens beteende i en väteatom. Den kvantmekaniska modellen för atomen kommer från lösningen till Schrödingers ekvation. Kvantisering av elektronenergier är ett krav för att lösa ekvationen. Detta skiljer sig från Bohr-modellen, där kvantisering helt enkelt antogs utan matematisk grund.
Minns att i Bohr-modellen, elektronens exakta väg var begränsad till mycket väldefinierade cirkulära banor runt kärnan. Den kvantmekaniska modellen är en radikal avvikelse från det. Lösningar på Schrödinger-vågekvationen, kallad vågfunktioner, ger bara sannolikheten att hitta en elektron vid en given punkt runt kärnan. Elektroner färdas inte runt kärnan i enkla cirkulära banor.
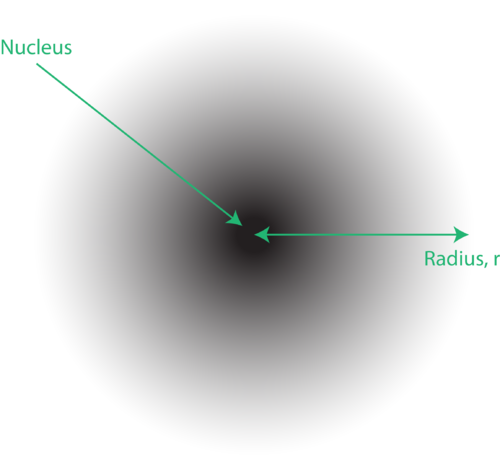
Figur 1. En elektronmoln: det mörkare området närmare kärnan indikerar en hög sannolikhet för att hitta elektronen, medan den ljusare regionen längre bort från kärnan indikerar en lägre sannolikhet för att hitta elektronen.
Elektronernas placering i atomens kvantmekaniska modell kallas ofta ett elektronmoln. Elektronmolnet kan tänkas på följande sätt: Föreställ dig att du placerar ett fyrkantigt papper på golvet med en prick i cirkeln som representerar kärnan. Ta nu en markör och släpp den på papperet upprepade gånger, gör små märken vid varje punkt markören träffar. Om du tappar markören många, många gånger kommer det övergripande prickmönstret att vara ungefär cirkulärt. Om du siktar mot centrum ganska bra kommer det att finnas fler punkter nära kärnan och gradvis färre punkter när du rör dig bort från den. Varje punkt representerar en plats där elektronen kan vara vid ett givet tillfälle. På grund av osäkerhetsprincipen finns det inget sätt att veta exakt var elektronen är. Ett elektronmoln har variabla densiteter: en hög densitet där elektronen är mest sannolikt att vara och en låg densitet där elektronen är minst sannolikt att vara (Figur 1).
För att specifikt definiera formen på molnet är det vanligt att hänvisa till det område i rymden inom vilket det finns en 90% sannolikhet för att hitta elektronen. Detta kallas en orbital, det tredimensionella området i rymden som indikerar var det finns en hög sannolikhet för att hitta en elektron.
Sammanfattning
- Schrödinger-vågen ekvationen ersatte Bohrs idéer om elektronplacering med en osäkerhetsfaktor.
- Elektronens position kan bara ges som en sannolikhet att elektronen är någonstans i ett visst område.
Övning
Använd länken nedan för att svara på följande frågor:
http://science.howstuffworks.com/atom8.htm
- Vad var ett problem med Bohr-modellen av atomen?
- Vad visade Heisenberg om elektroner?
- Vad härledde Schrödinger?
Granskning
- Vad kräver atomens kvantmekaniska vy?
- Vad är en vågfunktion?
- Vad föreslår ett elektronmoln med hög densitet?
Ordlista
- elektronmoln: Platsen för elektroner i kvantmekanisk modell av atomen.
- orbital: Det tredimensionella området i rymden som indikerar var det är hög sannolikhet att hitta en elektron.
- kvantmekanisk modell: En modell av atomen som härrör från Schrödinger-vågekvationen och hanterar sannolikheter.
- vågfunktion: Ge bara sannolikheten att hitta en elektron vid en given punkt runt kärnan.
