Newsflash
El newsflash interrumpe su programa de TV favorito. «Ha habido un atraco en el First National Bank. El sospechoso huyó en un automóvil y se cree que se encuentra en algún lugar del distrito del centro. Se pide a todos que estén alerta». El ladrón solo puede ubicarse dentro de un área determinada; la policía no tiene una ubicación exacta, solo una idea general sobre el paradero del ladrón.
En 1926, El físico austriaco Erwin Schrödinger (1887-1961) utilizó la dualidad onda-partícula del electrón para desarrollar y resolver una ecuación matemática compleja que describía con precisión el comportamiento del electrón en un átomo de hidrógeno. El modelo mecánico cuántico del átomo proviene de la solución a la ecuación de Schrödinger. La cuantificación de las energías electrónicas es un requisito para resolver la ecuación. Esto es diferente al modelo de Bohr, en el que la cuantificación se asumió simplemente sin base matemática.
Recuerde que en el modelo de Bohr, la trayectoria exacta del electrón se restringió a órbitas circulares muy bien definidas alrededor del núcleo. El modelo de la mecánica cuántica es una desviación radical de eso. Las soluciones a la ecuación de onda de Schrödinger, llamadas funciones de onda, dan solo la probabilidad de encontrar un electrón en un punto dado alrededor del núcleo. Los electrones no viajan alrededor del núcleo en órbitas circulares simples.
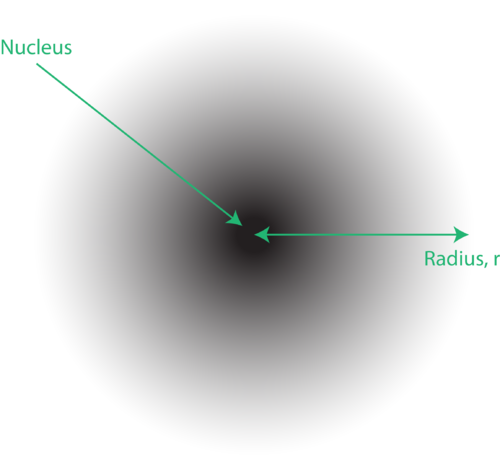
Figura 1. Una nube de electrones: la región más oscura más cercana al núcleo indica una alta probabilidad de encontrar el electrón, mientras que la región más clara más alejada del núcleo indica una menor probabilidad de encontrar el electrón.
La ubicación de los electrones en el modelo mecánico cuántico del átomo se denomina a menudo nube de electrones. La nube de electrones se puede pensar de la siguiente manera: Imagine colocar una hoja de papel cuadrada en el piso con un punto en el círculo que representa el núcleo. Ahora tome un marcador y colóquelo en el papel repetidamente, haciendo pequeñas marcas en cada punto que golpea el marcador. Si suelta el marcador muchas, muchas veces, el patrón general de puntos será aproximadamente circular. Si apunta hacia el centro razonablemente bien, habrá más puntos cerca del núcleo y progresivamente menos puntos a medida que se aleja de él. Cada punto representa una ubicación donde el electrón podría estar en un momento dado. Debido al principio de incertidumbre, no hay forma de saber exactamente dónde está el electrón. Una nube de electrones tiene densidades variables: una densidad alta donde es más probable que esté el electrón y una densidad baja donde es menos probable que esté el electrón (Figura 1).
Para definir específicamente la forma de la nube, se acostumbra referirse a la región del espacio dentro de la cual existe un 90% de probabilidad de encontrar el electrón. Esto se llama orbital, la región tridimensional del espacio que indica dónde hay una alta probabilidad de encontrar un electrón.
Resumen
- La onda de Schrödinger La ecuación reemplazó las ideas de Bohr sobre la ubicación de los electrones con un factor de incertidumbre.
- La ubicación del electrón solo se puede dar como una probabilidad de que el electrón esté en algún lugar de un área determinada.
Práctica
Utilice el enlace a continuación para responder las siguientes preguntas:
http://science.howstuffworks.com/atom8.htm
- ¿Cuál fue un problema con el modelo de Bohr del átomo?
- ¿Qué mostró Heisenberg sobre los electrones?
- ¿Qué derivó Schrödinger?
Repaso
- ¿Qué requiere la vista mecánica cuántica del átomo?
- ¿Qué es una función de onda?
- ¿Qué sugiere una nube de electrones de alta densidad?
Glosario
- nube de electrones: La ubicación de la electrones en el modelo mecánico cuántico del átomo.
- orbital: la región tridimensional del espacio que indica dónde hay una alta probabilidad de encontrar un electrón.
- modelo mecánico cuántico: un modelo de el átomo que se deriva de la ecuación de onda de Schrödinger y trata con probabilidades.
- función de onda: Proporcione solo la probabilidad de encontrar un electrón en un punto dado alrededor del núcleo.
