Newsflash
Newsflash afbryder dit yndlings-tv-program. “Der har været en hold-up i First National Bank. Den mistænkte flygtede i en bil og menes at være et sted i centrum. Alle bliver bedt om at være på vagt.” Røveren kan kun lokaliseres inden for et bestemt område – politiet har ikke en nøjagtig placering, bare en generel idé om, hvor tyven befinder sig.
I 1926 Den østrigske fysiker Erwin Schrödinger (1887–1961) brugte elektronens bølgepartikel-dualitet til at udvikle og løse en kompleks matematisk ligning, der nøjagtigt beskrev elektronens opførsel i et brintatom. Den kvantemekaniske model for atomet kommer fra opløsningen til Schrödingers ligning. Kvantisering af elektronenergier er et krav for at løse ligningen. Dette er i modsætning til Bohr-modellen, hvor kvantisering simpelthen blev antaget uden matematisk grundlag.
Husk, at i Bohr-modellen, elektronens nøjagtige sti var begrænset til meget veldefinerede cirkulære baner omkring kernen. Den kvantemekaniske model er en radikal afvigelse fra det. Løsninger til Schrödinger-bølgeligning, kaldet bølgefunktioner, giver kun sandsynligheden for at finde en elektron på et givet punkt omkring kernen. Elektroner bevæger sig ikke rundt om kernen i enkle cirkulære baner.
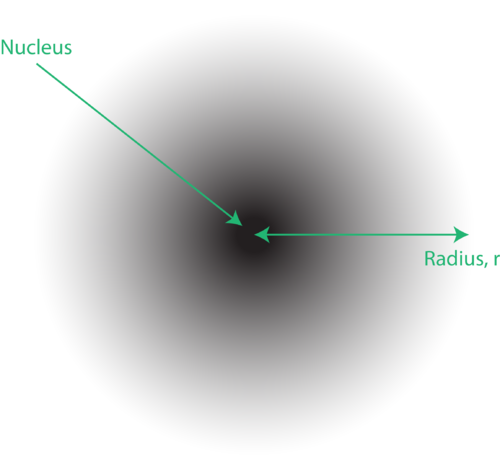
Figur 1. En elektronsky: det mørkere område nærmere kernen indikerer en høj sandsynlighed for at finde elektronen, mens den lysere region længere væk fra kernen indikerer en lavere sandsynlighed for at finde elektronen.
Elektronernes placering i atommens kvantemekaniske model betegnes ofte som en elektronsky. Elektronskyen kan tænkes på følgende måde: Forestil dig at placere et firkantet stykke papir på gulvet med en prik i cirklen, der repræsenterer kernen. Tag nu en markør, og slip den gentagne gange på papiret, og lav små mærker på hvert punkt, markøren rammer. Hvis du taber markøren mange, mange gange, vil det samlede mønster af prikker være omtrent cirkulært. Hvis du sigter mod centrum rimeligt godt, vil der være flere prikker nær kernen og gradvist færre prikker, når du bevæger dig væk fra det. Hver prik repræsenterer et sted, hvor elektronen kunne være på et hvilket som helst tidspunkt. På grund af usikkerhedsprincippet er der ingen måde at vide nøjagtigt, hvor elektronen er. En elektronsky har variable tætheder: en høj densitet, hvor elektronen mest sandsynligt er, og en lav densitet, hvor elektronen er mindst sandsynlig (figur 1).
For specifikt at definere formen på skyen, er det sædvanligt at henvise til det område af rummet, inden for hvilket der er en 90% sandsynlighed for at finde elektronen. Dette kaldes en orbital, det tredimensionelle område af rummet, der angiver, hvor der er stor sandsynlighed for at finde en elektron.
Resumé
- Schrödinger-bølgen ligning erstattede Bohr-idéerne om elektronplacering med en usikkerhedsfaktor.
- Elektronens placering kan kun gives som en sandsynlighed for, at elektronen er et eller andet sted i et bestemt område.
Øv dig
Brug nedenstående link til at besvare følgende spørgsmål:
http://science.howstuffworks.com/atom8.htm
- Hvad var et problem med atomens Bohr-model?
- Hvad viste Heisenberg om elektroner?
- Hvad udledte Schrödinger?
Review
- Hvad kræver det kvantemekaniske billede af atomet?
- Hvad er en bølgefunktion?
- Hvad antyder en elektronsky med høj densitet?
Ordliste
- elektronsky: Placeringen af elektroner i kvantemekanisk model af atomet.
- orbital: Det tredimensionale område af rummet, der angiver, hvor der er stor sandsynlighed for at finde en elektron.
- kvantemekanisk model: En model for atomet, der stammer fra Schrödinger-bølgeligning og beskæftiger sig med sandsynligheder.
- bølgefunktion: Giv kun sandsynligheden for at finde en elektron på et givet punkt omkring kernen.
