Cele nauczania
- Pisanie równania chemiczne dla wody działającej jako kwas i zasada.
Woda (H2O) jest interesującym związkiem pod wieloma względami. Tutaj rozważymy jego zdolność do zachowania się jak kwas lub zasada.
W pewnych okolicznościach cząsteczka wody zaakceptuje proton i tym samym będzie działać jako zasada Brønsteda-Lowry’ego. Widzieliśmy przykład w rozpuszczaniu HCl w H2O:
\
W innych okolicznościach cząsteczka wody może być dawcą protonu i tym samym działać jak kwas Brønsteda-Lowry’ego. Na przykład w obecności jonu amidowego (patrz przykład 4 w sekcji 10.2) cząsteczka wody przekazuje proton, tworząc amoniak jako produkt:
\
W tym przypadku , NH2− to zasada Brønsteda-Lowry’ego (akceptor protonów).
Zatem, w zależności od okoliczności, H2O może działać jako kwas Brønsteda-Lowry’ego lub zasada Brønsteda-Lowry’ego. Woda nie jest jedyną substancją, która w niektórych przypadkach może reagować jako kwas lub jako zasada w innych, ale z pewnością jest to najpowszechniejszy przykład – i najważniejszy. Substancja, która może oddać lub przyjąć proton, w zależności od okoliczności, nazywana jest związkiem amfiprotycznym.
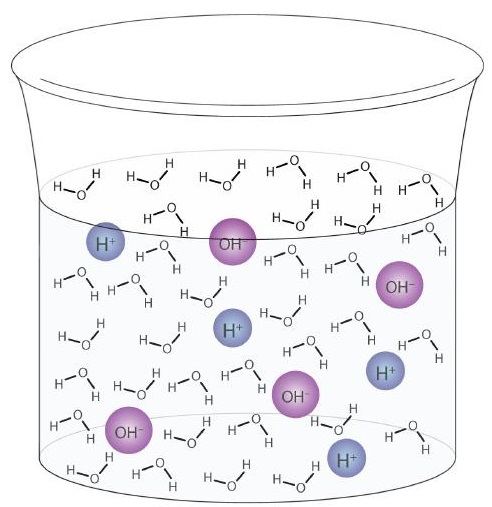
Cząsteczka wody może działać jako kwas lub zasada nawet w próbce czystej wody. Około 6 na każde 100 milionów (6 na 108) cząsteczek wody ulega następującej reakcji:
\
Proces ten nazywa się autojonizacją wody (Rysunek \ (\ PageIndex {1} \)) i występuje w każdej próbce wody, niezależnie od tego, czy jest czysta, czy stanowi część roztworu. Autojonizacja zachodzi do pewnego stopnia w każdym płynie amfiprotycznym. (Dla porównania, ciekły amoniak również ulega autojonizacji, ale tylko około 1 cząsteczka na milion miliardów (1 na 1015) reaguje z inną cząsteczką amoniaku.)
Ćwiczenia przeglądu koncepcji
- Wyjaśnij, jak woda może działać jak kwas.
- Wyjaśnij, jak woda może działać jako zasada.
Odpowiedzi
- W odpowiednich warunkach H2O może przekazać proton, czyniąc go kwasem Brønsteda-Lowry’ego.
- W odpowiednich warunkach H2O może przyjąć proton, czyniąc go Brønsted-Lowry baza.
Kluczowe wnioski
- Cząsteczki wody mogą działać zarówno jako kwas, jak i zasada, w zależności od warunki.
