Oppimistavoitteet
- kirjoittaa kemialliset yhtälöt vedelle, joka toimii happona ja emäksenä.
Vesi (H2O) on mielenkiintoinen yhdiste monilta osin. Tässä tarkastellaan sen kykyä käyttäytyä happona tai emäksenä.
Joissakin olosuhteissa vesimolekyyli hyväksyy protonin ja toimii siten Brønsted-Lowry-emäksenä. Näimme esimerkin HCl: n liuottamisesta H20: een:
\
Muissa olosuhteissa vesimolekyyli voi lahjoittaa protonin ja toimia siten Brønsted-Lowry-happona. Esimerkiksi amidi-ionin läsnä ollessa (katso esimerkki 4 osassa 10.2) vesimolekyyli luovuttaa protonin, jolloin tuotteeksi muodostuu ammoniakki:
\
Tässä tapauksessa , NH2− on Brønsted-Lowry-emäs (protoniakseptori).
Joten H2O voi olosuhteista riippuen toimia joko Brønsted-Lowry -happona tai Brønsted-Lowry-emäksenä. Vesi ei ole ainoa aine, joka voi reagoida happona joissakin tapauksissa tai emäksenä joissakin tapauksissa, mutta se on varmasti yleisin esimerkki – ja tärkein. Aine, joka voi joko luovuttaa tai hyväksyä protonin olosuhteista riippuen, kutsutaan amfifroottiseksi yhdisteeksi.
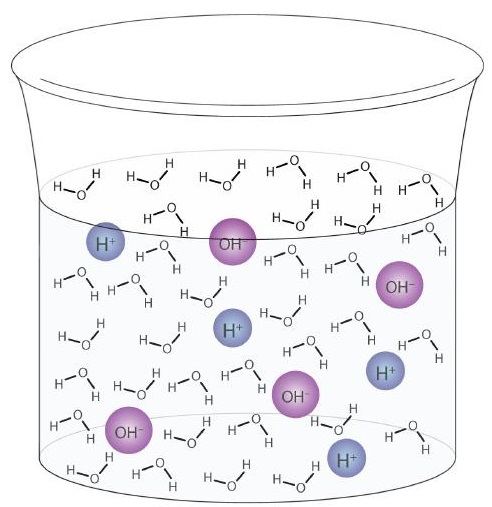
Vesimolekyyli voi toimia happona tai emäksenä jopa puhtaan veden näytteessä. Noin 6 100 miljoonasta vesimolekyylistä (6 108: sta) käy läpi seuraavan reaktion:
\
Tätä prosessia kutsutaan veden autoionisaatioksi (Kuva \ (\ PageIndex {1} \)) ja esiintyy jokaisessa vesinäytteessä, riippumatta siitä, onko se puhdasta vai osa liuosta. Autoionisaatio tapahtuu jossain määrin missä tahansa amfifroottisessa nesteessä. (Vertailun vuoksi nestemäinen ammoniakki läpikäy myös autoionisaation, mutta vain noin yksi molekyyli miljoonasta miljardista (yksi 1015: stä) reagoi toisen ammoniakkimolekyylin kanssa.)
Käsitteiden tarkistusharjoitukset
- Selitä, miten vesi voi toimia happona.
- Selitä, miten vesi voi toimia emäksenä.
Vastaukset
- H2O voi oikeissa olosuhteissa lahjoittaa protonin, mikä tekee siitä Brønsted-Lowry-hapon.
- Oikeissa olosuhteissa H2O voi hyväksyä protonin, mikä tekee siitä Brønsted-Lowry -hapon. emäs.
keskeinen takeaway
- vesimolekyylit voivat toimia sekä happona että emäksenä riippuen olosuhteet.
