Leerdoelen
- Schrijven chemische vergelijkingen voor water dat als zuur en als base fungeert.
Water (H2O) is in veel opzichten een interessante verbinding. Hier zullen we kijken naar zijn vermogen om zich te gedragen als een zuur of een base.
In sommige omstandigheden zal een watermolecuul een proton accepteren en dus als een Brønsted-Lowry-base werken. We zagen een voorbeeld bij het oplossen van HCl in H2O:
\
In andere omstandigheden kan een watermolecuul een proton afstaan en zo fungeren als een Brønsted-Lowry-zuur. In aanwezigheid van het amide-ion (zie Voorbeeld 4 in Sectie 10.2) doneert een watermolecuul bijvoorbeeld een proton, waardoor ammoniak als product ontstaat:
\
In dit geval , NH2− is een Brønsted-Lowry-base (de protonacceptor).
Dus, afhankelijk van de omstandigheden, kan H2O werken als een Brønsted-Lowry-zuur of als een Brønsted-Lowry-base. Water is niet de enige stof die in sommige gevallen als een zuur kan reageren of in andere als een base, maar het is zeker het meest voorkomende voorbeeld – en de belangrijkste. Een stof die een proton kan doneren of accepteren, afhankelijk van de omstandigheden, wordt een amfiprotische verbinding genoemd.
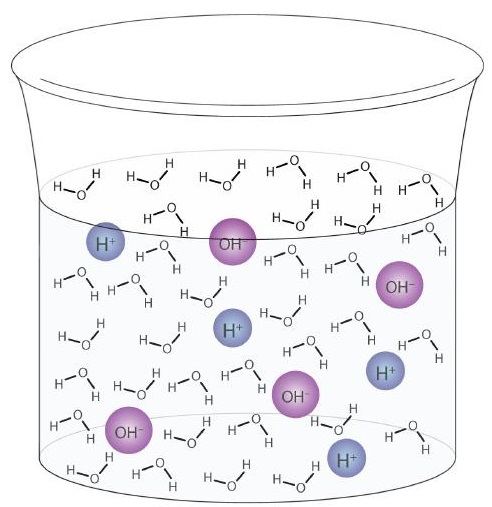
Een watermolecuul kan werken als een zuur of een base, zelfs in een monster van zuiver water. Ongeveer 6 op de 100 miljoen (6 op 108) watermoleculen ondergaan de volgende reactie:
\
Dit proces wordt de auto-ionisatie van water genoemd (Figuur \ (\ PageIndex {1} \)) en komt voor in elk watermonster, of het nu puur is of een deel van een oplossing. Auto-ionisatie treedt tot op zekere hoogte op in elke amfiprotische vloeistof. (Ter vergelijking: vloeibare ammoniak ondergaat ook auto-ionisatie, maar slechts ongeveer 1 molecuul op een miljoen miljard (1 op 1015) reageert met een ander ammoniakmolecuul.)
Concept Review-oefeningen
- Leg uit hoe water als zuur kan werken.
- Leg uit hoe water als basis kan werken.
Antwoorden
- Onder de juiste omstandigheden kan H2O een proton doneren, waardoor het een Brønsted-Lowry-zuur wordt.
- Onder de juiste omstandigheden kan H2O een proton accepteren, waardoor het een Brønsted-Lowry wordt basis.
Key Takeaway
- Watermoleculen kunnen zowel als zuur als als base werken, afhankelijk van de voorwaarden.
