Objetivos de aprendizaje
- Escribir ecuaciones químicas para el agua que actúa como ácido y como base.
El agua (H2O) es un compuesto interesante en muchos aspectos. Aquí, consideraremos su capacidad para comportarse como un ácido o una base.
En algunas circunstancias, una molécula de agua aceptará un protón y, por lo tanto, actuará como una base de Brønsted-Lowry. Vimos un ejemplo en la disolución de HCl en H2O:
\
En otras circunstancias, una molécula de agua puede donar un protón y así actuar como un ácido de Brønsted-Lowry. Por ejemplo, en presencia del ion amida (vea el Ejemplo 4 en la Sección 10.2), una molécula de agua dona un protón, produciendo amoníaco como producto:
\
En este caso , NH2− es una base de Brønsted-Lowry (el aceptor de protones).
Por tanto, dependiendo de las circunstancias, el H2O puede actuar como un ácido de Brønsted-Lowry o como una base de Brønsted-Lowry. El agua no es la única sustancia que puede reaccionar como ácido en algunos casos o como base en otros, pero sin duda es el ejemplo más común y el más importante. Una sustancia que puede donar o aceptar un protón, según las circunstancias, se llama compuesto anfiprótico.
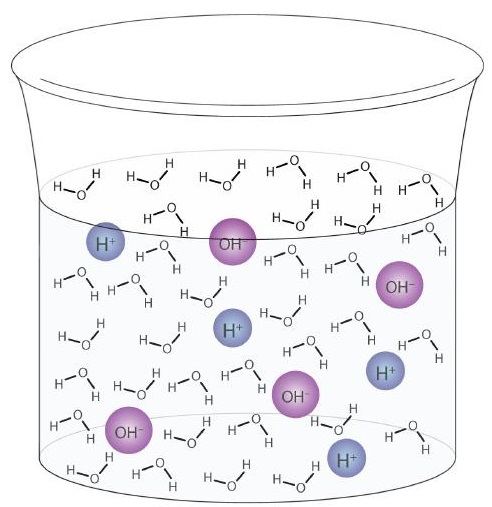
Una molécula de agua puede actuar como un ácido o una base incluso en una muestra de agua pura. Aproximadamente 6 de cada 100 millones (6 de cada 108) moléculas de agua experimentan la siguiente reacción:
\
Este proceso se denomina autoionización del agua (Figura \ (\ PageIndex {1} \)) y se encuentra en cada muestra de agua, ya sea pura o parte de una solución. La autoionización ocurre hasta cierto punto en cualquier líquido anfiprótico. (A modo de comparación, el amoníaco líquido también se autoioniza, pero solo una molécula en un millón de billones (1 en 1015) reacciona con otra molécula de amoníaco).
Ejercicios de repaso de conceptos
- Explica cómo el agua puede actuar como ácido.
- Explica cómo el agua puede actuar como base.
Respuestas
- En las condiciones adecuadas, el H2O puede donar un protón, convirtiéndolo en un ácido de Brønsted-Lowry.
- En las condiciones adecuadas, el H2O puede aceptar un protón, convirtiéndolo en un Brønsted-Lowry base.
Conclusión clave
- Las moléculas de agua pueden actuar como un ácido y una base, dependiendo de las condiciones.
