Lernziele
- Schreiben Chemische Gleichungen für Wasser, das als Säure und als Base wirkt.
Wasser (H2O) ist in vielerlei Hinsicht eine interessante Verbindung. Hier betrachten wir seine Fähigkeit, sich als Säure oder Base zu verhalten.
Unter bestimmten Umständen nimmt ein Wassermolekül ein Proton auf und wirkt somit als Brønsted-Lowry-Base. Wir haben ein Beispiel für das Auflösen von HCl in H2O gesehen:
\
Unter anderen Umständen kann ein Wassermolekül ein Proton abgeben und somit als Brønsted-Lowry-Säure wirken. In Gegenwart des Amidions (siehe Beispiel 4 in Abschnitt 10.2) spendet beispielsweise ein Wassermolekül ein Proton, wodurch Ammoniak als Produkt entsteht:
\
In diesem Fall , NH2− ist eine Brønsted-Lowry-Base (der Protonenakzeptor).
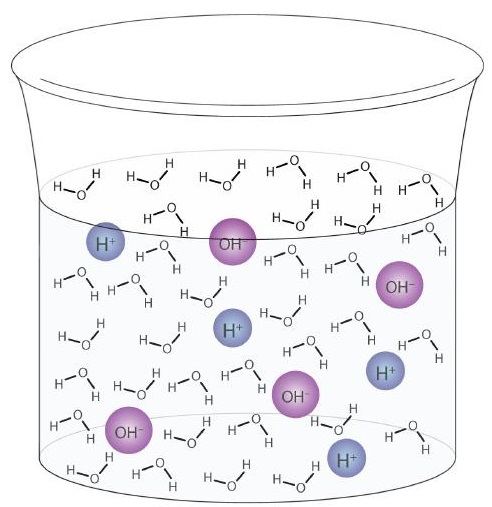
Abhängig von den Umständen kann H2O entweder als Brønsted-Lowry-Säure oder als Brønsted-Lowry-Base wirken. Wasser ist nicht die einzige Substanz, die in einigen Fällen als Säure oder in anderen als Base reagieren kann, aber es ist sicherlich das häufigste und wichtigste Beispiel. Eine Substanz, die je nach den Umständen entweder ein Proton spenden oder annehmen kann, wird als amphiprotische Verbindung bezeichnet. Ein Wassermolekül kann selbst in einer Probe aus reinem Wasser als Säure oder Base wirken. Ungefähr 6 von 100 Millionen (6 von 108) Wassermolekülen reagieren folgendermaßen:
\
Dieser Prozess wird als Autoionisierung von Wasser bezeichnet (Abbildung \ (\ PageIndex {1}). \)) und kommt in jeder Wasserprobe vor, unabhängig davon, ob sie rein oder Teil einer Lösung ist. Die Autoionisierung tritt bis zu einem gewissen Grad in jeder amphiprotischen Flüssigkeit auf. (Zum Vergleich: Flüssiges Ammoniak wird ebenfalls autoionisiert, aber nur etwa 1 Molekül in einer Million Milliarden (1 in 1015) reagiert mit einem anderen Ammoniakmolekül.)
Übungen zur Konzeptüberprüfung
- Erklären Sie, wie Wasser als Säure wirken kann.
- Erklären Sie, wie Wasser als Base wirken kann.
Antworten
- Unter den richtigen Bedingungen kann H2O ein Proton abgeben, wodurch es zu einer Brønsted-Lowry-Säure wird.
- Unter den richtigen Bedingungen kann H2O ein Proton aufnehmen und es zu einem Brønsted-Lowry machen Base.
Key Takeaway
- Wassermoleküle können je nach Abhängigkeit sowohl als Säure als auch als Base wirken die Bedingungen.
