학습 목표
- 쓰기 산과 염기로 작용하는 물에 대한 화학 방정식.
물 (H2O)은 여러면에서 흥미로운 화합물입니다. 여기서 우리는 산이나 염기로 작용하는 능력을 고려할 것입니다.
어떤 상황에서 물 분자는 양성자를 받아들이고 따라서 Brønsted-Lowry 염기로 작용합니다. H2O에서 HCl을 용해하는 예를 보았습니다.
\
다른 상황에서 물 분자는 양성자를 기증하여 Brønsted-Lowry 산으로 작용할 수 있습니다. 예를 들어, 아미드 이온이있는 경우 (10.2 절의 예 4 참조) 물 분자는 양성자를 제공하여 암모니아를 생성물로 만듭니다.
\
이 경우 , NH2-는 Brønsted-Lowry 염기 (양성자 수용체)입니다.
따라서 H2O는 상황에 따라 Brønsted-Lowry 산 또는 Brønsted-Lowry 염기로 작용할 수 있습니다. 물은 어떤 경우에는 산으로 반응하거나 다른 경우에는 염기로 반응 할 수있는 유일한 물질은 아니지만, 확실히 가장 일반적인 예이자 가장 중요한 물질입니다. 상황에 따라 양성자를 기증하거나받을 수있는 물질을 양양 자성 화합물이라고합니다.
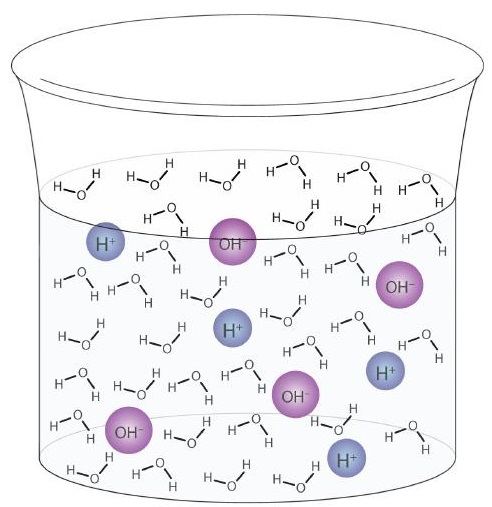
물 분자는 순수한 물 샘플에서도 산 또는 염기 역할을 할 수 있습니다. 1 억 개 중 6 개 (108 개 중 6 개)의 물 분자가 다음 반응을 겪습니다.
\
이 과정을 물의 자동 이온화라고합니다 (그림 \ (\ PageIndex {1} \)) 순수한 물이든 용액의 일부이든 모든 물 샘플에서 발생합니다. 자가 이온화는 양양 자성 액체에서 어느 정도 발생합니다. (비교를 위해 액체 암모니아도자가 이온화를 거치지 만 100 억분의 1 (1015 분의 1) 분자 만이 다른 암모니아 분자와 반응합니다.)
개념 검토 실습
- 물이 산으로 작용하는 방법을 설명합니다.
- 물이 염기로 작용하는 방법을 설명합니다.
답변
- 적절한 조건에서 H2O는 양성자를 기증하여 Brønsted-Lowry 산으로 만들 수 있습니다.
- 적절한 조건에서 H2O는 양성자를 받아 Brønsted-Lowry로 만들 수 있습니다. 염기.
핵심 요약
- 물 분자는 다음에 따라 산과 염기로 작용할 수 있습니다. 조건.
