Obiettivi di apprendimento
- Scrivere equazioni chimiche per l’acqua che agisce come un acido e come una base.
L’acqua (H2O) è un composto interessante sotto molti aspetti. Qui considereremo la sua capacità di comportarsi come un acido o una base.
In alcune circostanze, una molecola d’acqua accetterà un protone e quindi agirà come una base di Brønsted-Lowry. Abbiamo visto un esempio nella dissoluzione di HCl in H2O:
\
In altre circostanze, una molecola d’acqua può donare un protone e quindi agire come un acido di Brønsted-Lowry. Ad esempio, in presenza dello ione ammide (vedere l’Esempio 4 nella Sezione 10.2), una molecola d’acqua dona un protone, producendo l’ammoniaca come prodotto:
\
In questo caso , NH2− è una base di Brønsted-Lowry (l’accettore di protoni).
Quindi, a seconda delle circostanze, H2O può agire sia come acido di Brønsted-Lowry che come base di Brønsted-Lowry. L’acqua non è l’unica sostanza che può reagire come un acido in alcuni casi o come una base in altri, ma è certamente l’esempio più comune e quello più importante. Una sostanza che può donare o accettare un protone, a seconda delle circostanze, è chiamata composto anfiprotico.
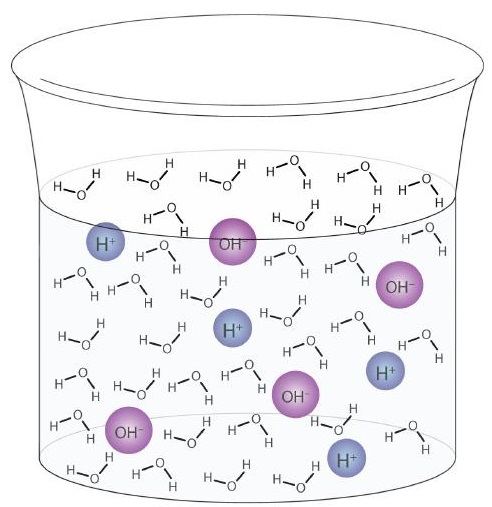
Una molecola d’acqua può agire come un acido o una base anche in un campione di acqua pura. Circa 6 molecole d’acqua su 100 milioni (6 su 108) subiscono la seguente reazione:
\
Questo processo è chiamato autoionizzazione dell’acqua (Figura \ (\ PageIndex {1} \)) e si trova in ogni campione d’acqua, sia esso puro o parte di una soluzione. L’autoionizzazione si verifica in una certa misura in qualsiasi liquido anfiprotico. (Per confronto, anche l’ammoniaca liquida subisce l’autoionizzazione, ma solo circa 1 molecola su un milione di miliardi (1 su 1015) reagisce con un’altra molecola di ammoniaca.)
Esercizi di revisione dei concetti
- Spiega come l’acqua può agire come un acido.
- Spiega come l’acqua può agire come una base.
Risposte
- Nelle giuste condizioni, H2O può donare un protone, rendendolo un acido di Brønsted-Lowry.
- Nelle giuste condizioni, H2O può accettare un protone, rendendolo un Brønsted-Lowry base.
Conclusione chiave
- Le molecole d’acqua possono agire sia come un acido che come una base, a seconda le condizioni.
