Læringsmål
- At skrive kemiske ligninger for vand, der fungerer som en syre og som en base.
Vand (H2O) er en interessant forbindelse i mange henseender. Her vil vi overveje dets evne til at opføre sig som en syre eller en base.
Under nogle omstændigheder vil et vandmolekyle acceptere en proton og dermed fungere som en Brønsted-Lowry-base. Vi så et eksempel på opløsning af HCI i H2O:
\
Under andre omstændigheder kan et vandmolekyle donere en proton og dermed fungere som en Brønsted-Lowry-syre. For eksempel i nærværelse af amidionen (se eksempel 4 i afsnit 10.2) donerer et vandmolekyle en proton, hvilket gør ammoniak som et produkt:
\
I dette tilfælde , NH2− er en Brønsted-Lowry-base (protonacceptoren).
Så afhængigt af omstændighederne kan H2O fungere som enten en Brønsted-Lowry-syre eller en Brønsted-Lowry-base. Vand er ikke det eneste stof, der kan reagere som en syre i nogle tilfælde eller en base i andre, men det er bestemt det mest almindelige eksempel – og det vigtigste. Et stof, der enten kan donere eller acceptere en proton, afhængigt af omstændighederne, kaldes en amfiprotisk forbindelse.
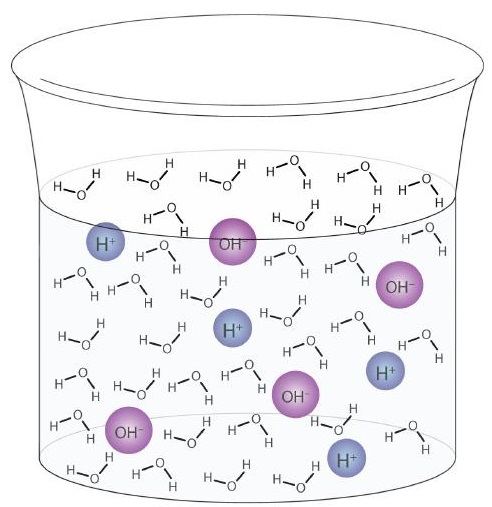
Et vandmolekyle kan fungere som en syre eller en base selv i en prøve af rent vand. Cirka 6 ud af hver 100 millioner (6 ud af 108) vandmolekyler gennemgår følgende reaktion:
\
Denne proces kaldes autoionisering af vand (Figur \ (\ PageIndex {1} \)) og forekommer i hver vandprøve, hvad enten det er rent eller en del af en opløsning. Autoionisering forekommer til en vis grad i enhver amfiprotisk væske. (Til sammenligning gennemgår også flydende ammoniak autoionisering, men kun ca. 1 molekyle i en million milliarder (1 ud af 1015) reagerer med et andet ammoniakmolekyle.)
Øvelser i konceptanmeldelse
- Forklar, hvordan vand kan fungere som en syre.
- Forklar, hvordan vand kan fungere som en base.
Svar
- Under de rigtige forhold kan H2O donere en proton, hvilket gør den til en Brønsted-Lowry-syre.
- Under de rette betingelser kan H2O acceptere en proton, hvilket gør den til en Brønsted-Lowry base.
Key Takeaway
- Vandmolekyler kan fungere som både en syre og en base afhængigt af betingelserne.
