Objectifs d’apprentissage
- Écrire équations chimiques pour l’eau agissant comme acide et comme base.
L’eau (H2O) est un composé intéressant à bien des égards. Ici, nous allons considérer sa capacité à se comporter comme un acide ou une base.
Dans certaines circonstances, une molécule d’eau acceptera un proton et agira ainsi comme une base de Brønsted-Lowry. Nous avons vu un exemple de dissolution de HCl dans H2O:
\
Dans d’autres circonstances, une molécule d’eau peut donner un proton et agir ainsi comme un acide de Brønsted-Lowry. Par exemple, en présence de l’ion amide (voir l’exemple 4 dans la section 10.2), une molécule d’eau donne un proton, faisant de l’ammoniac comme produit:
\
Dans ce cas , NH2− est une base de Brønsted-Lowry (l’accepteur de protons).
Ainsi, selon les circonstances, H2O peut agir soit comme un acide de Brønsted-Lowry, soit comme une base de Brønsted-Lowry. L’eau n’est pas la seule substance qui peut réagir sous forme d’acide dans certains cas ou de base dans d’autres, mais c’est certainement l’exemple le plus courant et le plus important. Une substance qui peut donner ou accepter un proton, selon les circonstances, est appelée un composé amphiprotique.
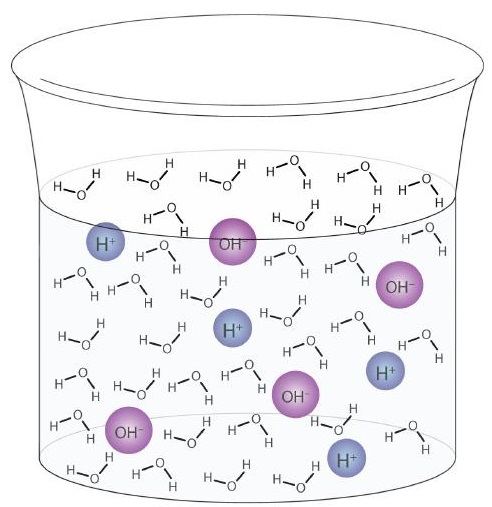
Une molécule d’eau peut agir comme un acide ou une base même dans un échantillon d’eau pure. Environ 6 molécules d’eau sur 100 millions (6 sur 108) subissent la réaction suivante:
\
Ce processus s’appelle l’autoionisation de l’eau (Figure \ (\ PageIndex {1} \)) et se produit dans chaque échantillon d’eau, qu’elle soit pure ou qu’elle fasse partie d’une solution. L’autoionisation se produit dans une certaine mesure dans tout liquide amphiprotique. (À titre de comparaison, l’ammoniac liquide subit également une auto-ionisation, mais seulement environ 1 molécule sur un million de milliards (1 sur 1015) réagit avec une autre molécule d’ammoniac.)
Exercices de révision de concept
- Expliquez comment l’eau peut agir comme un acide.
- Expliquez comment l’eau peut agir comme une base.
Réponses
- Dans les bonnes conditions, H2O peut donner un proton, ce qui en fait un acide de Brønsted-Lowry.
- Dans les bonnes conditions, H2O peut accepter un proton, ce qui en fait un Brønsted-Lowry base.
À retenir
- Les molécules d’eau peuvent agir à la fois comme un acide et comme une base, selon les conditions.
