Objetivos de aprendizagem
- Para escrever equações químicas para a água agindo como um ácido e uma base.
A água (H2O) é um composto interessante em muitos aspectos. Aqui, consideraremos sua capacidade de se comportar como um ácido ou uma base.
Em algumas circunstâncias, uma molécula de água aceitará um próton e, portanto, atuará como uma base de Brønsted-Lowry. Vimos um exemplo na dissolução de HCl em H2O:
\
Em outras circunstâncias, uma molécula de água pode doar um próton e, portanto, agir como um ácido de Brønsted-Lowry. Por exemplo, na presença do íon amida (ver Exemplo 4 na Seção 10.2), uma molécula de água doa um próton, fazendo amônia como produto:
\
Neste caso , NH2− é uma base de Brønsted-Lowry (o aceitador de prótons).
Portanto, dependendo das circunstâncias, H2O pode atuar como um ácido de Brønsted-Lowry ou uma base de Brønsted-Lowry. A água não é a única substância que pode reagir como ácido em alguns casos ou como base em outros, mas é certamente o exemplo mais comum – e o mais importante. Uma substância que pode doar ou aceitar um próton, dependendo das circunstâncias, é chamada de composto anfiprótico.
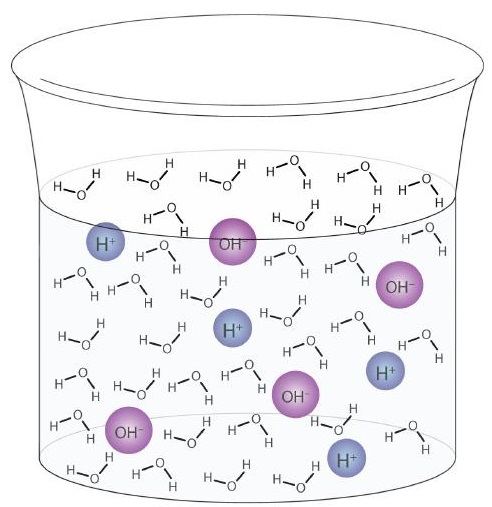
Uma molécula de água pode atuar como um ácido ou uma base mesmo em uma amostra de água pura. Cerca de 6 em cada 100 milhões (6 em 108) moléculas de água sofrem a seguinte reação:
\
Este processo é chamado de autoionização da água (Figura \ (\ PageIndex {1} \)) e ocorre em toda amostra de água, seja ela pura ou parte de uma solução. A autoionização ocorre até certo ponto em qualquer líquido anfiprótico. (Para comparação, a amônia líquida também sofre autoionização, mas apenas cerca de 1 molécula em um milhão de bilhões (1 em 1015) reage com outra molécula de amônia.)
Exercícios de revisão de conceito
- Explique como a água pode agir como um ácido.
- Explique como a água pode agir como uma base.
Respostas
- Sob as condições certas, H2O pode doar um próton, tornando-o um ácido de Brønsted-Lowry.
- Sob as condições certas, H2O pode aceitar um próton, tornando-o um Brønsted-Lowry base.
Principal vantagem
- As moléculas de água podem atuar como um ácido e uma base, dependendo de as condições.
