Obiective de învățare
- A scrie ecuații chimice pentru apa care acționează ca acid și ca bază.
Apa (H2O) este un compus interesant din multe puncte de vedere. Aici, vom lua în considerare capacitatea sa de a se comporta ca un acid sau o bază.
În unele circumstanțe, o moleculă de apă va accepta un proton și va acționa astfel ca o bază Brønsted-Lowry. Am văzut un exemplu în dizolvarea HCl în H2O:
\
În alte circumstanțe, o moleculă de apă poate dona un proton și poate acționa astfel ca un acid Brønsted-Lowry. De exemplu, în prezența ionului amidă (a se vedea exemplul 4 din secțiunea 10.2), o moleculă de apă donează un proton, producând amoniac ca produs:
\
În acest caz , NH2− este o bază Brønsted-Lowry (acceptorul protonului).
Deci, în funcție de circumstanțe, H2O poate acționa fie ca acid Brønsted-Lowry, fie ca bază Brønsted-Lowry. Apa nu este singura substanță care poate reacționa ca acid în unele cazuri sau ca bază în altele, dar este cu siguranță cel mai frecvent exemplu – și cel mai important. O substanță care poate dona sau accepta un proton, în funcție de circumstanțe, se numește compus amfiprotic.
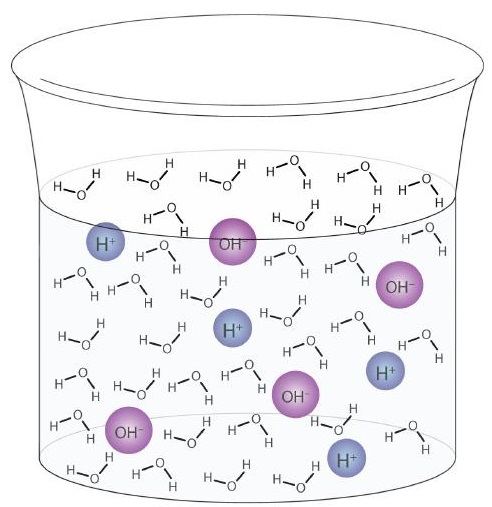
O moleculă de apă poate acționa ca un acid sau o bază chiar și într-o probă de apă pură. Aproximativ 6 din 100 de milioane (6 din 108) molecule de apă suferă următoarea reacție:
\
Acest proces se numește autoionizarea apei (Figura \ (\ PageIndex {1} \)) și apare în fiecare probă de apă, indiferent dacă este pură sau face parte dintr-o soluție. Autoionizarea are loc într-o oarecare măsură în orice lichid amfiprotic. (Pentru comparație, amoniacul lichid suferă și autoionizare, dar numai aproximativ 1 moleculă dintr-un milion de miliarde (1 în 1015) reacționează cu o altă moleculă de amoniac.)
Exerciții de revizuire a conceptelor
- Explicați cum poate acționa apa ca acid.
- Explicați cum poate acționa apa ca bază.
Răspunsuri
- În condițiile potrivite, H2O poate dona un proton, făcându-l un acid Brønsted-Lowry.
- În condițiile potrivite, H2O poate accepta un proton, făcându-l un Brønsted-Lowry bază.
Cheia de luat înapoi
- Moleculele de apă pot acționa atât ca acid, cât și ca bază, în funcție condițiile.
