Nozizeptoren können durch drei Arten von Stimuli im Zielgewebe aktiviert werden – Temperatur (thermisch), mechanisch (z. B. Dehnung / Dehnung) und chemisch (z. B. pH-Änderung) als Folge eines lokalen Entzündungsprozesses). Somit kann ein schädlicher Reiz in eine dieser drei Gruppen eingeteilt werden.
Die Begriffe Nozizeption und Schmerz sollten nicht synonym verwendet werden, da jeder ohne den anderen auftreten kann. Schmerzen, die durch die Aktivierung der Nozizeptoren entstehen, werden als nozizeptiver Schmerz bezeichnet. Nozizeptive Schmerzen können nach dem Gewebe klassifiziert werden, in dem die Nozizeptoraktivierung stattgefunden hat: oberflächliche somatische (z. B. Haut), tiefe somatische (z. B. Bänder / Sehnen / Knochen / Muskeln) oder viszerale (innere Organe).
Nozizeption-Pfad
Nicht jeder Nozizeptor reagiert auf jeden Typ von schädlichen Reizen. Das offensichtliche Fehlen einer Reaktion auf einen schädlichen Reiz kann auf unterschiedliche Rezeptoren zurückzuführen sein, die sich auf der Membran des Endterminals befinden (Ende des freien Nervs), oder die Reizintensität ist unzureichend. Normalerweise liegt die Stimulationsschwelle eines Nozizeptors unter der gewebeschädigenden Intensität. Nozizeptoren haben heterogene Eigenschaften, die auf mehrere Stimulusmodalitäten (polymodal) reagieren. Die Anwendung eines schädlichen Stimulus einer Modalität kann jedoch die Reaktionseigenschaften des Nozizeptors auf andere Modalitäten verändern. Auch die Anwendung eines bestimmten Stimulus über einen bestimmten Zeitraum kann langfristige Änderungen der Reaktionseigenschaften des Nozizeptors hervorrufen. Verletzungen und Entzündungen senken die Schwelle und erhöhen die Stärke der Reaktion auf einen bestimmten Reiz, ein Phänomen, das als periphere Sensibilisierung bekannt ist. Von besonderem Interesse sind die auf Wärme ansprechenden, aber mechanisch unempfindlichen, nicht myelinisierten Afferenzen, die nur bei der Einstellung einer Verletzung eine mechanische Empfindlichkeit entwickeln.
Nozizeptoren haben das morphologische Erscheinungsbild von freien Nervenenden. Der Begriff „freies Nervenende“ zeigt an, dass im Lichtmikroskop keine (korpuskuläre) Rezeptionsstruktur erkannt werden kann. Derzeit gibt es keine klaren ultrastrukturellen Unterschiede zwischen nicht nozizeptiven freien Nervenenden (z. B. empfindlichen Mechanorezeptoren und Thermorezeptoren) und nozizeptiven Funktionell verschiedene freie Nervenenden
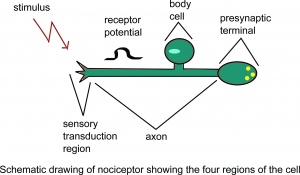
Schematische Darstellung des Nozizeptors mit dem Es wird angenommen, dass vier Regionen der Zelle.
unterschiedliche Sätze von Rezeptormolekülen in ihrer axonalen Membran besitzen. Rezeptormoleküle, die für die Funktion von Muskel-Nozizeptoren besonders wichtig sind, sind säureempfindliche Ionenkanäle (ASICs), die sich bei einem niedrigen Gewebe-pH öffnen, P2X3-Rezeptoren, die durch Bindung von Adenosintriphosphat (ATP) aktiviert werden, und der transiente Rezeptorpotentialrezeptor-Subtyp 1 (TRPV1), der gegenüber hohen Temperaturen, Capsaicin-Chemikalien und niedrigem pH-Wert empfindlich ist Neuropeptidsubstanz P hat Es wurde berichtet, dass es überwiegend in nozizeptiven afferenten Fasern vorhanden ist. Während es im Nervensystem zahlreiche Neurotransmitter gibt, sind Peptide, Purine und exzitatorische Aminosäuren (EAA) die drei häufigsten, die an der nozizeptiven Übertragung beteiligt sind. Die EAA, insbesondere Glutamat, erzeugen die anfängliche exzitatorische Reaktion auf das postsynaptische Neuron zweiter Ordnung, gefolgt von der Freisetzung von Peptiden, einschließlich Substanz P, was eine längere Depolarisation und eine anhaltende nozizeptive Übertragung bewirkt. Es sind Nozizeptoren vorhanden in vielen Körpergeweben, aber nicht in Gelenkknorpel, viszeraler Pleura, Lungenparenchym, Perikard, Gehirn und Nabelschnurgewebe gefunden.
Arten von Nozizeptoren
Mehrere Klassen von Nozizeptoren wurden beschrieben. Einige Nozizeptoren reagieren auf schädliche Kälte, schädliche Hitze und hochschwellige mechanische Reize sowie auf eine Vielzahl chemischer Mediatoren. Obwohl Nozizeptoren polymodal sind, können sie auf der Grundlage der Reaktion auf mechanische Reize weiter in zwei Hauptklassen unterteilt werden, was zu einer Unterscheidung zwischen mechanisch empfindlichen Afferenzen (MSA) und mechanisch unempfindlichen Afferenzen (MIA) führt, die als Afferenzen mit sehr hohen mechanischen Schwellenwerten definiert sind oder reagieren nicht auf mechanische Reize.
Nozizeptoren können anhand der Leitungsgeschwindigkeit ihrer Axone oder des Faserdurchmessers klassifiziert werden. Dies ist Gruppe III und IV oder Aδ bzw. C.
Myelinisierte Afferenzen vom Typ Aδ mit mittlerem Durchmesser, die akute, gut lokalisierte, scharfe Schmerzen vom Typ Stechen vermitteln, die als afferente Gruppe III bekannt sind. Aδ-afferente Fasern haben einen durchschnittlichen Faserdurchmesser von 2 bis 5 mm und eine Leitgeschwindigkeit von 5 bis 30 m / s. Aδ-Nozizeptoren können weiter in zwei Typen unterteilt werden (es scheint ungefähr 50% von jedem Typ zu existieren).
- Typ I Aδ sind mechanisch empfindliche Afferenzen (MSA), die mit einer sich langsam anpassenden Entladung auf stark reagieren Druck unterbrechen.Sie reagieren auch auf Hitze und chemische Reize und haben relativ hohe Wärmeschwellen (> 50C).
- Aδ-Nozizeptoren vom Typ II haben eine niedrigere Wärmeschwelle als Einheiten vom Typ I, aber sehr hohe mechanische Schwellenwerte (als mechanisch unempfindliche Afferenzen – MIAs bezeichnet). Die Aktivität dieser Afferenz vermittelt mit ziemlicher Sicherheit die „erste“ akute Schmerzreaktion auf schädliche Hitze. Sie wurde im Kniegelenk, in den Eingeweiden und in der Hornhaut berichtet.
Typ C nichtmyelinisierte afferente Fasern, die vermitteln Schlecht lokalisierte stumpfe, brennende, sogenannte „zweite“ oder langsame Schmerzen werden als Gruppe IV bezeichnet. Der durchschnittliche Faserdurchmesser liegt unter 2 mm und die Leitgeschwindigkeit beträgt 2 m / s oder weniger. Die nichtmyelinisierten C-Fasern sind ebenfalls heterogen. C-Faser-Afferenzen können basierend auf ihrer Reaktion auf mechanische Reize in zwei Klassen unterteilt werden. Wie die myelinisierten Aδ-afferenten Fasern sind die meisten C-Fasern polymodal, dh sie umfassen eine Population, die sowohl mechanisch als auch wärmeempfindlich ist (CMHs). Die Reaktion von CMHs wird auch stark von der Reizgeschichte beeinflusst. Es werden sowohl Müdigkeit als auch Sensibilisierung beobachtet. Eine Abnahme der Reaktion auf Wärme wird auch nach mechanischen Reizen, die auf das Empfangsfeld ausgeübt werden, oder elektrischen Reizen, die auf den Nervenstamm ausgeübt werden, beobachtet. Dies legt nahe, dass Müdigkeit als Reaktion auf eine gegebene Stimulusmodalität durch heterologe Stimulation induziert werden kann, dh durch Anregung mit einem Stimulus einer anderen Modalität. Dies sind die vorherrschenden Arten von C-Faser-Nozizeptoren in der Haut von Säugetieren. Mechanisch unempfindliche C-Fasern (C-MIAs) reagieren entweder nicht auf mechanische Reize oder haben eine sehr hohe mechanische Schwelle. Diese Afferenzen reagieren auf Hitze und verschiedene schädliche chemische Reize (z. B. Capsaicin, Histamin) und werden häufig als Chemorezeptoren angesehen.
Zusammenfassend ist das unmittelbare, gut lokalisierte, geizige Schmerzempfinden vermittelt durch myelinisierte Nervenfasern mit kleinem Durchmesser, Typ Aδ. C-Fasern vermitteln schlecht lokalisierte anatomische Schmerzen, sie haben einen schmerzenden und brennenden Charakter, treten später als das erste Gefühl auf und es ist schwierig, ihre Stärke abzuschätzen.
TRP-Kanäle
Nozizeptoren reagieren auf bestimmte Temperaturbereiche und mechanische Reize.
Das periphere Ende des Axons enthält eingekapselte Proteine, sogenannte Transduktionsproteine (TRP), die durch einen bestimmten Stimulus aktiviert werden können. Die Multigen-Superfamilie mit transientem Rezeptorpotential (TRP) codiert integrale Membranproteine, die als Ionenkanäle fungieren. Die TRP-Kanalfamilie ist von Interesse, da mehrere Mitglieder an der Signalübertragung von Nozizeptoren beteiligt waren.
Schädliche Kälte- und schädliche Wärmestimuli werden von Nozizeptoren aus Aδ- und C-Fasern erfasst. Die TRP-Kanalfamilie bietet eine Gruppe von Molekülen, mit denen thermische Veränderungen erfasst werden können. Der gesamte Temperaturbereich von schädlicher Kälte bis zu schädlicher Hitze scheint durch die Aktivität in diesen Ionenkanälen übertragen zu werden. TRPM8 und TRPV3 / 4 codieren kühl bzw. warm, TRPA1 wandelt schädliche Kälte um und TRPV1 / 2 spürt schädliche Wärme. Einige der wärmeempfindlichen TRP-Kanäle reagieren auch auf chemische und mechanische Reize.
Beispielsweise ist TRPV1 für die Übertragung des Nozizeptivums durch entzündliche und hypothermische Wirkungen von Vanilloidverbindungen essentiell und trägt zur akuten thermischen Nozizeption und thermischen Hyperalgesie nach einer Gewebeverletzung bei. Der TRPV1-Strom wird durch Bradykinin und den Nervenwachstumsfaktor über mehrere mögliche Mechanismen potenziert und auch durch Protonen und Capsaicin aktiviert, die „scharfe“ Verbindung in Chilischoten. Im Gegensatz zur Hyperalgesie nach intensiven schädlichen Reizen kann eine längere Exposition gegenüber Capsaicin zu einer anschließenden Desensibilisierung führen.
Während die Entdeckung wärmeempfindlicher TRP-Kanäle unser Verständnis der Transduktionsmechanismen thermischer Reize erheblich verbessert hat, sind die Ergebnisse bei Tieren mit selektiven Gendeletionen eindeutig weisen darauf hin, dass mehrere und noch unbekannte Transduktionsmechanismen durch thermische Reize aktiviert werden.
Chemische Mediatoren
Verletzungen führen zur lokalen Freisetzung zahlreicher Chemikalien aus nicht-neuronalen Zellen (z. B. Fibroblasten, Mastzellen, Neutrophilen, Monozyten und Blutplättchen) sowie aus den sensorischen Terminals primärer afferenter Fasern die den Entzündungsprozess vermitteln oder erleichtern. Entzündungsmediatoren umfassen Prostaglandine, Leukotriene, Bradykinin, Serotonin, Histamin, SP, Thromboxane, Thrombozytenaktivierungsfaktor, Purine wie Adenosin und ATP, Protonen und freie Radikale. Zytokine wie Interleukine und Tumornekrosefaktor sowie Neurotrophine, insbesondere NGF, werden ebenfalls während der Entzündung erzeugt.Es ist anzumerken, dass die meisten dieser Chemikalien (hauptsächlich Substanzen wie Bradykinin und Prostaglandin E2) im Allgemeinen nicht direkt Nozizeptoren aktivieren, sondern das Schmerzempfinden als Reaktion auf natürliche Reize und andere endogene Chemikalien durch Erhöhen der Wirkfrequenz verstärken potenzielles Brennen.
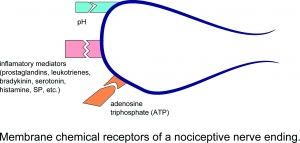
Chemische Membranrezeptoren eines nozizeptiven Nervenende.
Die Aktivierung von Nozizeptoren überträgt nicht nur afferente Nachrichten an das Rückenhorn des Rückenmarks, sondern leitet auch den Prozess der neurogenen Entzündung ein. Eine neurogene Entzündung führt zur Freisetzung von Neurotransmittern, insbesondere von Substanz P und Calcitonin-Gen-verwandtem Peptid (CGRP), was zu einer schweren Vasodilatation sowie zu einem Plasmaaustritt von Proteinen und Flüssigkeit aus postkapillären Venolen führt.
Zwei Chemikalien sind von besonderem Interesse:
- Adenosintriphosphat (ATP)
ATP ist das energietragende Molekül in allen Zellen des Körpers. Es wird während eines Traumas und anderer pathologischer Veränderungen, die mit dem Zelltod verbunden sind, aus allen Geweben freigesetzt. Aus diesem Grund wurde ATP als allgemeine Signalsubstanz für Gewebetrauma und Schmerzen angesehen. In mikroneurographischen Studien am Menschen aktivierte die Injektion von ATP 60% der mechanisch reagierenden und mechanisch unempfindlichen C-nozizeptiven Fasern, ohne diese Fasern für mechanische oder Wärmestimuli zu sensibilisieren. ATP aktiviert purinerge P2X3-Rezeptoren in Nozizeptoren und verursacht eine Entladung. ATP ist besonders wichtig bei Muskelschmerzen, da es in hoher Konzentration in Muskelzellen vorhanden ist.
- Veränderung der Protonen im pH-Wert des Gewebes
Säureempfindliche Ionenkanäle (ASICs) bilden eine Familie von Rezeptormolekülen, die gegenüber einem Abfall des pH-Werts empfindlich und offen sind bei verschiedenen pH-Werten. Die Kanalproteine reagieren bereits zu kleinen pH-Änderungen. Diese Rezeptorfamilie (zum Beispiel ASIC1 und ASIC3) ist besonders wichtig für Muskelschmerzen, da fast alle pathologischen Veränderungen im Muskel mit einem Abfall des Gewebe-pH einhergehen, z. B. anstrengende körperliche Betätigung, Ischämie und Entzündung.
Lage der Nozizeptoren
Die Zellkörper der Nozizeptoren befinden sich in den dorsalen Wurzelganglien (DRG) für die Peripherie und im Trigeminusganglion für das Gesicht. Ihre Axone erstrecken sich in das periphere Nervensystem und enden in Ästen, die Rezeptionsfelder bilden.
- Haut
- Muskeln
- Sehnen
- Gelenk
- Viscera
- 1.0 1.1 Loeser JD, Treede RD. Das Kyoto-Protokoll der IASP Basic Pain Terminology. Schmerzen. 2008; 137 (3): 473–7. doi: 10.1016 / j.pain.2008.04.025. PMID 18583048
- Basbaum AI, Jessell T. Die Wahrnehmung von Schmerz. In: Kandel ER, Schwartz J, Jessell T. Herausgeber. Prinzipien der Neurowissenschaften. New York: Appleton und Lange; 2000. S. 472-491
- 3,0 3,1 3,2 3,3 3,4 3,5 Meyer RA, Ringkamp M., Campbell JN, Raja SN. Periphere Mechanismen der kutanen Nozizeption. In: McMahon SB, Koltzenburg M, Herausgeber. Wall und Melzacks Lehrbuch des Schmerzes. London: Elsevier; 2006. S. 3–34.
- Lloyd DPC. Neuronenmuster, die die Übertragung von ipsilateralen Hinterbeinreflexen bei Katzen steuern. J Neurophysiol. 1943; 6: 293–315
- 5,0 5,1 5,2 Schaible HG, Schmidt RF. Auswirkungen einer experimentellen Arthritis auf die sensorischen Eigenschaften feinartikulär afferenter Einheiten. Journal of Neurophysiology. 1985; 54: 1109-1122
- Häbler HJ, Jänig W, Koltzenburg M.Ein neuartiger Typ eines nichtmyelinisierten chemosensitiven Nozizeptors in der akut entzündeten Harnblase. Agenten und Aktionen. 1988; 25: 219-221 Tanelian DL. Cholinerge Aktivierung einer Population von Hornhaut-afferenten Nerven. Experimentelle Hirnforschung. 1991; 86: 414-420 LaMotte RH, Campbell JN. Vergleich der Reaktionen von warmen und nozizeptiven C-Faser-Afferenzen bei Affen mit menschlichen Urteilen über thermische Schmerzen. Journal of Neurophysiology. 1978; 41: 509-528 Treede RD, Meyer RA, Raja SN, Campbell JN. Hinweise auf zwei unterschiedliche Wärmeübertragungsmechanismen bei nozizeptiven primären Afferenzen, die die Affenhaut innervieren. Zeitschrift für Physiologie. 1995; 483: 747-758 Schepers RJ, Ringkamp M. Thermorezeptoren und wärmeempfindliche Afferenzen. Neurowissenschaften & Biobehavioral Reviews. 2010; 34 (2): 177-184 Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. Der Capsaicinrezeptor: ein hitzeaktivierter Ionenkanal im Schmerzweg. Nature 1997; 389: 816–824
- Bjur D, Alfredson H, Forsgren S. Das Innervationsmuster der menschlichen Achillessehne: Untersuchungen der Normal- und Tendinosesehne mit Markern für die allgemeine und sensorische Innervation. Cell Tissue Res. 2005; 320: 201-206
- 13,0 13,1 Ashton IK, Ashton BA, Gibson SJ, Polak JM, Jaffray DC, Eisenstein SM. Morphologische Grundlage für Rückenschmerzen: Nachweis von Nervenfasern und Neuropeptiden in der Lendenfacettengelenkkapsel, jedoch nicht im Ligamentum fl avum. J Orthop Res. 1992; 10 (1): 72-78 Kiter E., Karaboyun T., Tufan AC, Acar K. ImmunhistochemicalfckLRdemonstration von freien Nervenenden im iliolumbalen Band. Wirbelsäule. 2010; 35 (4): E101-4. doi: 10.1097 / BRS.0b013e3181ae561d.
- Hirsch C, Ingelmark BE, Miller M. Die anatomische Grundlage für LowfckLRback-Schmerzen. Studien zum Vorhandensein sensorischer Nervenenden infckLRligamentöse, Kapsel- und Bandscheibenstrukturen in der menschlichen Lendenwirbelsäule. Acta Orthop Scand. 1963; 33: 1–17.
- Möller, Aage (22.04.2014). Schmerz, seine Anatomie, Physiologie und Behandlung. Kindle Edition.
Freie Nervenenden, die in der Haut enden, sind die Maschinerie zur Signalisierung lokaler mechanischer, thermischer und chemischer Veränderungen. Die große Mehrheit der freien Nervenenden in der Haut wird als polymodale Nozizeptoren bezeichnet, da sie mehrere Rezeptoren enthalten und somit auf verschiedene Kombinationen des oben genannten Stimulus reagieren. Hochschwellige Mechanorezeptoreinheiten vom Typ I Aδ sind in haariger und kahler Haut dicht verteilt.
Rezeptormoleküle, die für die besonders wichtig sind Funktion von Muskel-Nozizeptoren sind säureempfindliche Ionenkanäle (ASICs), die sich bei einem niedrigen Gewebe-pH öffnen, P2X3-Rezeptoren, die durch Bindung von Adenosintriphosphat (ATP) aktiviert werden, und der transiente Rezeptorpotentialrezeptorsubtyp 1 (TRPV1), der gegenüber hohen empfindlich ist Temperaturen und niedriger pH-Wert.
Im Skelettmuskel scheinen die freien Nervenenden ziemlich gleichmäßig verteilt zu sein. Es wurde kein Unterschied zwischen dem proximalen und dem distalen Teil des Gastrocnemius-Soleus-Muskels der Ratte festgestellt. In derselben Studie wurde jedoch festgestellt, dass die Nervenfaserdichte im Peritendineum der Calcaneal-Sehne der Ratte um ein Vielfaches höher ist als die im GS-Muskel. Im Gegensatz dazu waren die Kollagenfaserbündel des eigentlichen Sehnengewebes nahezu frei von freien Nervenenden.
Innervation von Achillessehnen beim Menschen wird durch Nerven aus den umgebenden Muskeln und durch kleine Faszikel aus Hautnerven bereitgestellt, aber dies beinhaltet alle Nervenenden. Freie Nervenenden sind in den Sehnen vertreten, aber hauptsächlich im peritendinösen Gewebe sind sie Schmerzrezeptoren. Die Anzahl und Lage aller Nervenfasern und Nervenenden variiert je nach Funktion der Sehne und ist stärker in den kleineren Sehnen vertreten, die an feinen Bewegungen beteiligt sind.
Nozizeptoren in Gelenken befinden sich innerhalb der Gelenkkapsel, der Bänder und der proximalen Sehnen, des Knochens, des Periostes, des Gelenkfettpolsters und um die Blutgefäße, jedoch nicht im Gelenkknorpel. Nozizeptive Afferenzen mit hoher Schwelle enden hauptsächlich in der Synovia und im Periost und reagieren normalerweise nur auf die Bewegung des Gelenks über die Arbeitsgrenzen hinaus. Nach einer Gelenkschädigung verändern zwei Faktoren zusammen die mechanische Empfindlichkeit von Gelenk-Nozizeptoren.Erstens verändern physische Veränderungen (Gelenkerguss und Gewebeödem) die auf das Gelenkgewebe ausgeübten Ruhe- und Bewegungskräfte, und zweitens sensibilisieren im beschädigten Gewebe freigesetzte Entzündungsmediatoren artikuläre nozizeptive Afferenzen, indem sie an Rezeptoren an den Nervenenden binden. Viele Nozizeptoren des Gelenks reagieren auf harmlose Bewegungen, werden jedoch zunehmend aktiviert, wenn Bewegungen den physiologischen Arbeitsbereich überschreiten, während andere Nozizeptoren ausschließlich bei schädlichen Bewegungen aktiv sind. Die dritte Gruppe sogenannter stiller Nozizeptoren ist normalerweise inaktiv und reagiert nur unter pathologischen Umständen wie Entzündungen.
Es wurde gezeigt, dass die Lendenfacettengelenkkapsel durch Nozizeptoren und propriozeptive Fasern stark innerviert ist. Im Normalzustand haben Nozizeptoren, wie sie in der Facettengelenkkapsel zu sehen sind, einen hohen Schwellenwert und es wird nicht erwartet, dass sie sich entladen, es sei denn, die Belastungen sind supraphysiologisch. Bei Vorliegen einer pathologischen Gelenkentzündung können chemische Medoviatoren der Synovitis diese Nozizeptoren sensibilisieren, und es sind möglicherweise keine supraphysiologischen Stressniveaus mehr erforderlich, um den Schmerz zu stimulieren. Solche Entzündungsmediatoren (Substanz P, Bradykinin, Phospholipase A2) wurden in der Facettengelenkkapsel nachgewiesen.
Nozizeptoren in Bandscheiben sind normalerweise auf das äußere Drittel des Rings beschränkt, könnten das Substrat sein bei diskogenem Schmerz, wenn sie sich über den größeren ringförmigen Bereich ausdehnen und entlang des Gefäßsystems und der Sicherungen weiter in die entartete Scheibe eindringen. Diese C- und A δ-Fasern sind wahrscheinlich für die Übertragung von Schmerzreaktionen verantwortlich. Das hintere Längsband und die äußeren Ringfaserschichten der Bandscheibe enthalten viele nozizeptive Fasern. Nervenfasern und Nervenenden treten auch im subchondralen Knochen der Zygapophysialgelenke auf. Sie treten in Erosionskanälen auf, die sich vom subchondralen Knochen bis zum Gelenkknorpel erstrecken.
Eine Studie von (Kiter et al., 2010) am Menschen zeigte sowohl freie als auch eingekapselte Nervenenden im menschlichen iliolumbalen Band. Eine Studie von (Hirsch et al., 1963) legte das Vorhandensein feiner Nervenfasern und komplexer nicht eingekapselter Enden in den supraspinösen und intraspinösen Bändern nahe.
Viszerale Nozizeptoren reagieren nicht auf Schnitt- oder Verbrennungsverletzungen wie ihre Gegenstücke im peripheren Hautgewebe. Stattdessen werden sie als Reaktion auf pathologische Veränderungen aktiviert. Schmerz erzeugende Reize in den Eingeweiden, einschließlich Traktion auf dem Mesenterium, Entzündung, Ausdehnung von hohlen muskelwandigen Organen wie Magen-Darm, Harnwegen, Gallenblase und starke Kontraktionen von Muskelschichten, die solche Hohlorgane umgeben, chemische Reizstoffe oder Ischämie in Organen wie dem Herz. Die Verteilung dieser Fasern variiert zwischen den Organen. Hochschwellenrezeptoren innervieren ausschließlich Organe, von denen Schmerz das einzige bewusste Gefühl ist (dh Harnleiter, Niere, Lunge, Herz), aber relativ wenige in Organen, die harmlose und schädliche Empfindungen hervorrufen (z. B. Dickdarm, Magen und Blase). meistens durch niedrigschwellige Rezeptoren innerviert. Organe wie Leber, Lunge, Nieren und Bauchspeicheldrüse haben nur wenige Rezeptoren, aber der Schmerz dieser Organe beruht hauptsächlich auf der Aktivierung von Rezeptoren in den Kapseln dieser Organe. Die nozizeptive Stimulation der Eingeweide führt zu diffusen Schmerzen, die schwer zu lokalisieren sind. Afferente nozizeptive Fasern in Eingeweiden werden in Verbindung mit sympathischen und parasympathischen Nerven gefunden. Die Mehrzahl der viszeralen Organe wird vom Vagusnerv innerviert, Studien zeigen jedoch nicht eindeutig, ob dieser Nerv nozizeptiven afferenten Input liefern kann oder nicht. Einige Studien zeigen jedoch deutlich, dass vagale Afferenzen Informationen über hochintensive mechanische Reize an das Zentralnervensystem übermitteln. Eine Reihe von Studien mit Menschen oder Tieren hat gezeigt, dass Patienten mit Wirbelsäulenläsionen Schmerzen melden können, die wahrscheinlich aus dem Bereich der viszeralen Organe stammen.
