Les nocicepteurs peuvent être activés par trois types de stimulus dans le tissu cible – température (thermique), mécanique (par exemple étirement / déformation) et chimique (par exemple changement de pH à la suite d’un processus inflammatoire local). Ainsi, un stimulus nocif peut être classé dans l’un de ces trois groupes.
Les termes nociception et douleur ne doivent pas être utilisés comme synonymes, car chacun peut se produire l’un sans l’autre. La douleur résultant de l’activation des nocicepteurs est appelée douleur nociceptive. La douleur nociceptive peut être classée en fonction du tissu dans lequel l’activation du nocicepteur s’est produite: somatique superficielle (par exemple la peau), somatique profonde (par exemple ligaments / tendons / os / muscles) ou viscérale (organes internes).
Voie de Nociception
Tous les nocicepteurs ne répondent pas à chaque type de stimuli nocifs. L’absence apparente de réponse à un stimulus nocif peut résulter de différents récepteurs situés sur la membrane de l’extrémité terminale (terminaison nerveuse libre) ou l’intensité du stimulus est insuffisante. Habituellement, le seuil de stimulation d’un nocicepteur est inférieur à l’intensité endommageant les tissus. Les nocicepteurs ont des propriétés hétérogènes, répondant à de multiples modalités de stimulation (polymodales). Cependant, l’application d’un stimulus nocif d’une modalité peut modifier les propriétés de réponse du nocicepteur à d’autres modalités. En outre, l’application d’un stimulus particulier pendant une durée donnée peut induire des changements à long terme dans les propriétés de réponse du nocicepteur. Les blessures et l’inflammation diminuent le seuil et augmentent l’amplitude de la réponse pour un stimulus donné, un phénomène connu sous le nom de sensibilisation périphérique. Les afférents non myélinisés sensibles à la chaleur, mais mécaniquement insensibles, qui développent une sensibilité mécanique uniquement dans le cadre d’une blessure sont particulièrement intéressants.
Les nocicepteurs ont l’aspect morphologique de terminaisons nerveuses libres. Le terme «terminaison nerveuse libre» indique qu’au microscope optique, aucune structure réceptrice (corpusculaire) ne peut être reconnue. À l’heure actuelle, il n’existe aucune différence ultrastructurale claire entre les terminaisons nerveuses libres non nociceptives (par exemple, les mécanorécepteurs et thermorécepteurs sensibles) et les terminaisons nociceptives . Fonctionnellement, différentes terminaisons nerveuses libres
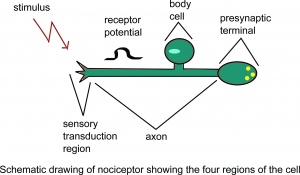
Schéma du nociceptor montrant le quatre régions de la cellule.
sont supposées posséder différents ensembles de molécules réceptrices dans leur membrane axonale. Les molécules réceptrices qui sont particulièrement importantes pour la fonction des nocicepteurs musculaires sont des canaux ioniques sensibles à l’acide (ASIC) qui s’ouvrent à un faible pH tissulaire, les récepteurs P2X3 qui sont activés par liaison à l’adénosine triphosphate (ATP) et le récepteur potentiel transitoire de sous-type 1 (TRPV1) qui est sensible aux températures élevées, à la capsaïcine chimique et à un pH bas. la substance neuropeptidique P a ont été signalés comme étant principalement présents dans les fibres afférentes nociceptives. Bien qu’il existe de nombreux neurotransmetteurs dans le système nerveux, les trois plus courants participant à la transmission nociceptive sont les peptides, les purines et les acides aminés excitateurs (EAA). L’EAA, en particulier le glutamate, produit la réponse excitatrice initiale sur le neurone postsynaptique de second ordre, suivie de la libération de peptides, dont la substance P, provoquant une dépolarisation plus prolongée et une transmission nociceptive soutenue
Des nocicepteurs sont présents dans de nombreux tissus corporels mais n’ont pas été trouvés dans le cartilage articulaire, la plèvre viscérale, le parenchyme pulmonaire, le péricarde, le cerveau et les tissus du cordon.
Types de nocicepteurs
Plusieurs classes de des nocicepteurs ont été décrits. Certains nocicepteurs réagissent au froid nocif, à la chaleur nocive et aux stimuli mécaniques à seuil élevé, ainsi qu’à une variété de médiateurs chimiques. Les nocicepteurs, bien que polymodaux, peuvent être divisés en deux classes principales sur la base de la réponse aux stimuli mécaniques, conduisant à une distinction entre les afférents mécaniquement sensibles (MSA) et les afférents mécaniquement insensibles (MIA) définis comme des afférents qui ont des seuils mécaniques très élevés ou ne répondent pas aux stimuli mécaniques.
Les nocicepteurs peuvent être classés par la vitesse de conduction de leurs axones ou le diamètre de leurs fibres, c’est-à-dire les groupes III et IV ord Aδ et C respectivement.
Afférentes myélinisées de type Aδ de diamètre moyen qui médient une douleur aiguë, bien localisée, de type piquage aigu, connue sous le nom d’afférence de groupe III. Les fibres afférentes Aô ont un diamètre moyen de fibre de 2 à 5 mm et une vitesse conductrice de 5 à 30 m / s. Les nocicepteurs Aδ peuvent être divisés en deux types (il semble exister à environ 50% de chaque type)
- Type I Les Aδ sont des afférents mécaniquement sensibles (MSA) qui répondent par une décharge s’adaptant lentement à une forte ponctuer la pression.Ils répondent également à la chaleur et aux stimuli chimiques et ont des seuils de chaleur relativement élevés (> 50C).
- Les nocicepteurs de type II Aδ ont un seuil de chaleur plus bas que les unités de type I mais ont des seuils mécaniques très élevés (appelés afférents mécaniquement insensibles – MIA). L’activité de cet afférent médiatise presque certainement la «première» réaction de douleur aiguë à la chaleur nocive. Ils ont été signalés dans l’articulation du genou, les viscères et la cornée.
Fibres afférentes non myélinisées de type C qui véhiculent les douleurs sourdes et brûlantes mal localisées, appelées «secondes» ou douleurs lentes sont appelées groupe IV. Le diamètre moyen des fibres est inférieur à 2 mm et la vitesse conductrice est de 2 m / s ou moins. Les fibres C non myélinisées sont également hétérogènes. Les afférents de fibres C peuvent être divisés en deux classes en fonction de leur réponse aux stimuli mécaniques. Comme les fibres afférentes myélinisées Aδ, la plupart des fibres C sont polymodales, c’est-à-dire qu’elles comprennent une population à la fois mécaniquement et thermosensible (CMH). La réponse des CMH est également fortement influencée par l’historique du stimulus. On observe à la fois une fatigue et une sensibilisation. Une diminution de la réponse à la chaleur est également observée suite à des stimuli mécaniques appliqués au champ récepteur ou à des stimuli électriques appliqués au tronc nerveux. Cela suggère que la fatigue en réponse à une modalité de stimulus donnée peut être induite par une stimulation hétérologue, c’est-à-dire par une excitation avec un stimulus d’une modalité différente. Ce sont le type prédominant de nocicepteurs de la fibre C dans la peau des mammifères. Les fibres C mécaniquement insensibles (C-MIA) ne répondent pas aux stimuli mécaniques ou ont un seuil mécanique très élevé. Ces afférents répondent à la chaleur et à divers stimuli chimiques nocifs (par exemple, la capsaïcine, l’histamine) et sont souvent considérés comme des chimiorécepteurs.
En résumé de ce qui précède, une sensation de douleur immédiate, bien localisée et avare est médiée par des fibres nerveuses myélinisées de petit diamètre, type Aδ. Les fibres C médiatisent une douleur de type anatomiquement mal localisée, elle a un caractère douloureux et brûlant, survient plus tard que la première sensation initiale et il est difficile d’estimer sa force.
Canaux TRP
Les nocicepteurs répondent à une certaine plage de températures et à un stimulus mécanique.
L’extrémité périphérique de l’axone contient des protéines encapsulées appelées protéines de transduction (TRP), qui peuvent être activées par un stimulus spécifique. La superfamille multigénique du potentiel de récepteur transitoire (TRP) code pour des protéines membranaires intégrales qui fonctionnent comme des canaux ioniques. La famille des canaux TRP est intéressante car plusieurs membres ont été impliqués dans la transduction du signal des nocicepteurs.
Des stimuli de chaleur nocifs froids et nocifs sont détectés par les nocicepteurs des fibres Aδ et C. La famille de canaux TRP fournit un groupe de molécules équipées pour détecter les changements thermiques. La gamme complète des températures, du froid nocif à la chaleur nocive, semble être transduite par l’activité de ces canaux ioniques. TRPM8 et TRPV3 / 4 codent respectivement froid et chaud, TRPA1 transmet le froid nocif et TRPV1 / 2 détecte la chaleur nocive. Certains des canaux TRP thermosensibles répondent également aux stimuli chimiques et mécaniques.
Par exemple, TRPV1 est essentiel pour la transduction du nociceptif par les effets inflammatoires et hypothermiques des composés vanilloïdes et contribue à la nociception thermique aiguë et à l’hyperalgésie thermique après une lésion tissulaire. Le courant TRPV1 est potentialisé par la bradykinine et le facteur de croissance nerveuse via plusieurs mécanismes possibles et est également activé par les protons et la capsaïcine, le composé «chaud» des piments. Contrairement à l’hyperalgésie consécutive à des stimuli nocifs intenses, une exposition prolongée à la capsaïcine peut entraîner une désensibilisation ultérieure.
Alors que la découverte de canaux TRP thermosensibles a grandement amélioré notre compréhension des mécanismes de transduction des stimuli thermiques, les résultats chez les animaux avec des délétions sélectives de gènes indiquent que des mécanismes de transduction multiples et encore inconnus sont engagés par des stimuli thermiques.
Médiateurs chimiques
Les lésions entraînent la libération locale de nombreux produits chimiques à partir de cellules non neuronales (p. ex. fibroblastes, mastocytes, neutrophiles, monocytes et plaquettes), ainsi que des terminaisons sensorielles des fibres afférentes primaires qui médiatisent ou facilitent le processus inflammatoire. Les médiateurs inflammatoires comprennent les prostaglandines, les leucotriènes, la bradykinine, la sérotonine, l’histamine, la SP, les thromboxanes, le facteur d’activation des plaquettes, les purines telles que l’adénosine et l’ATP, les protons et les radicaux libres. Des cytokines, telles que les interleukines et le facteur de nécrose tumorale, et les neurotrophines, en particulier le NGF, sont également générées pendant l’inflammation.Il convient de noter que la plupart de ces produits chimiques (principalement des substances telles que la bradykinine et la prostaglandine E2) sont généralement considérés comme n’activant pas directement les nocicepteurs, mais plutôt pour améliorer la sensation de douleur en réponse à des stimuli naturels et d’autres produits chimiques endogènes en augmentant la fréquence d’action déclenchement potentiel.
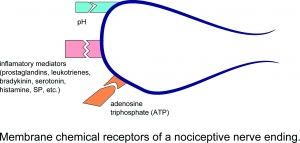
Récepteurs chimiques membranaires d’une terminaison nerveuse nociceptive.
L’activation des nocicepteurs transmet non seulement des messages afférents à la corne dorsale de la moelle épinière, mais initie également le processus d’inflammation neurogène. L’inflammation neurogène provoque une libération de neurotransmetteurs, notamment la substance P et le peptide lié au gène de la calcitonine (CGRP), ce qui conduit à une vasodilatation sévère, ainsi qu’une fuite plasmatique de protéines et de liquide des veinules post-capillaires.
Deux produits chimiques présentent un intérêt particulier:
- Adénosine triphosphate (ATP)
L’ATP est la molécule porteuse d’énergie dans toutes les cellules du corps. Il est libéré de tous les tissus lors d’un traumatisme et d’autres changements pathologiques associés à la mort cellulaire. Pour cette raison, l’ATP a été considéré comme une substance signal générale pour les traumatismes et la douleur tissulaires. Dans les études microneurographiques humaines, l’injection d’ATP a activé 60% des fibres C-nociceptives mécano-sensibles et mécano-insensibles sans sensibiliser ces fibres à des stimuli mécaniques ou thermiques. L’ATP active les récepteurs purinergiques P2X3 dans les nocicepteurs provoquant une décharge. L’ATP est particulièrement important pour les douleurs musculaires car il est présent dans les cellules musculaires en forte concentration.
- Altération des protons dans le pH des tissus
Les canaux ioniques sensibles à l’acide (ASIC) constituent une famille de molécules réceptrices sensibles à une baisse de pH et ouvertes à différentes valeurs de pH. Les protéines des canaux réagissent déjà à des changements de pH trop faibles. Cette famille de récepteurs (par exemple ASIC1 et ASIC3) est particulièrement importante pour les douleurs musculaires parce que presque tous les changements pathologiques dans les muscles sont accompagnés d’une baisse du pH tissulaire, par exemple, un exercice épuisant, une ischémie et une in fl ammation.
Localisation des nocicepteurs
Les corps cellulaires des nocicepteurs sont situés dans les ganglions de la racine dorsale (DRG) pour la périphérie et le ganglion trijumeau pour le visage. Leurs axones s’étendent dans le système nerveux périphérique et se terminent par des branches créant des champs réceptifs.
- Skin
Les terminaisons nerveuses libres se terminant dans la peau sont les mécanismes pour signaler les changements mécaniques, thermiques et chimiques locaux. La grande majorité des terminaisons nerveuses libres de la peau sont appelées nocicepteurs polymodaux car ils contiennent plusieurs récepteurs et répondent ainsi à diverses combinaisons du stimulus mentionné ci-dessus. Les unités de mécanorécepteurs à seuil élevé de type I Aδ sont densément distribuées dans la peau velue et glabre.
- Muscles
Molécules réceptrices particulièrement importantes pour la fonction des nocicepteurs musculaires sont les canaux ioniques sensibles à l’acide (ASIC) qui s’ouvrent à un pH tissulaire bas, les récepteurs P2X3 qui sont activés par la liaison de l’adénosine triphosphate (ATP) et le récepteur de potentiel transitoire de sous-type 1 (TRPV1) qui est sensible aux températures et pH bas.
Dans le muscle squelettique, les terminaisons nerveuses libres semblent être réparties assez uniformément. Aucune différence entre les parties proximale et distale du muscle gastrocnémien – soléaire du rat n’a été trouvée. Cependant, dans la même étude, la densité des fibres nerveuses dans le péritendineum du tendon calcanéen du rat s’est avérée plusieurs fois plus élevée que celle du muscle GS. En revanche, les faisceaux de fibres de collagène du tissu tendineux proprement dit étaient presque exempts de terminaisons nerveuses libres.
- Tendons
Innervation des tendons d’Achille humain est fourni par les nerfs des muscles environnants et par de petits faisceaux des nerfs cutanés, mais cela implique toutes les terminaisons nerveuses. Les terminaisons nerveuses libres sont représentées à l’intérieur des tendons, mais principalement dans les tissus péritendineux, sont des récepteurs de la douleur. Le nombre et l’emplacement de toutes les fibres nerveuses et terminaisons nerveuses varient en fonction de la fonction du tendon, étant plus représentés dans les petits tendons impliqués dans les mouvements fins.
- Articulation
Les nocicepteurs des articulations sont situés dans la capsule articulaire, les ligaments et les tendons proximaux, l’os, le périoste, le coussinet adipeux articulaire et autour des vaisseaux sanguins, mais pas dans le cartilage articulaire. Les afférences nociceptives à seuil élevé se terminent principalement dans la synoviale et le périoste et ne répondent normalement qu’au mouvement de l’articulation au-delà des limites de travail. Suite à des lésions articulaires, deux facteurs se combinent pour altérer la sensibilité mécanique des nocicepteurs articulaires.Premièrement, les changements physiques (épanchement articulaire et œdème tissulaire) modifient les forces de repos et induites par le mouvement exercées sur les tissus articulaires, et deuxièmement, les médiateurs inflammatoires libérés dans le tissu endommagé sensibilisent les afférents nociceptifs articulaires en se liant aux récepteurs situés sur les terminaisons nerveuses. De nombreux nocicepteurs de l’articulation répondent à des mouvements inoffensifs mais sont de plus en plus activés lorsque les mouvements dépassent la plage de travail physiologique, tandis que d’autres nocicepteurs sont actifs exclusivement lors de mouvements nocifs. Le troisième groupe de soi-disant nocicepteurs silencieux est normalement inactif et ne réagit que dans des circonstances pathologiques telles que l’inflammation.
Il a été démontré que la capsule articulaire de la facette lombaire est richement innervée par des nocicepteurs et des fibres proprioceptives. Dans un état normal, les nocicepteurs tels que ceux observés dans la capsule articulaire facettaire ont un seuil élevé et ne devraient pas se décharger à moins que les charges ne soient supraphysiologiques. Cependant, en présence d’une inflammation articulaire pathologique, les médiateurs chimiques de la synovite peuvent sensibiliser ces nocicepteurs et des niveaux supraphysiologiques de stress peuvent ne plus être nécessaires pour stimuler la douleur. De tels médiateurs inflammatoires (substance P, bradykinine, phospholipase A2) ont été détectés dans la capsule articulaire facettaire.
Les nocicepteurs dans les disques intervertébraux sont normalement limités au tiers externe de l’anneau, pourraient être le substrat pour la douleur discogène lorsqu’elles sont étendues sur la plus grande zone annulaire et pénètrent davantage dans le disque dégénéré le long du système vasculaire et des fi sures. Ces fibres C et A δ sont probablement responsables de la transmission des réponses à la douleur. Le ligament longitudinal postérieur et les couches annulus fi brosus externes du disque intervertébral contiennent beaucoup de fibres nociceptives. Les fibres nerveuses et les terminaisons nerveuses se trouvent également dans l’os sous-chondral des articulations zygapophysaires. Ils se produisent dans des canaux d’érosion s’étendant de l’os sous-chondral au cartilage articulaire.
Une étude humaine de (Kiter et al., 2010) a montré des terminaisons nerveuses libres et encapsulées dans le ligament iliolombaire humain. L’étude de (Hirsch et al., 1963) a suggéré la présence de fibres nerveuses fines et de terminaisons complexes non encapsulées dans les ligaments sus-épineux et intraspineux.
- Viscères
Les nocicepteurs viscéraux ne répondent pas aux coupures ou aux brûlures comme leurs homologues du tissu cutané périphérique. Au lieu de cela, ils sont activés en réponse à un changement pathologique. Douleur produisant des stimuli dans les viscères, y compris la traction sur le mésentère, l’inflammation, la distension des organes creux à parois musculaires tels que gastro-intestinaux, les voies urinaires, la vésicule biliaire et de fortes contractions des couches musculaires entourant ces organes creux, des irritants chimiques ou une ischémie dans des organes tels que cœur. La distribution de ces fibres varie selon les organes. Les récepteurs à seuil élevé innervent exclusivement les organes à partir desquels la douleur est la seule sensation consciente (c’est-à-dire l’uretère, les reins, les poumons, le cœur), mais sont relativement peu nombreux dans les organes qui fournissent des sensations inoffensives et nocives (par exemple, côlon, estomac et vessie), innervé principalement par des récepteurs à bas seuil. Les organes, tels que le foie, les poumons, les reins et le pancréas, ont peu de récepteurs, mais la douleur de ces organes provient principalement de l’activation de récepteurs dans les capsules de ces organes. La stimulation nociceptive des viscères entraîne une douleur diffuse difficile à localiser. Les fibres nociceptives afférentes des viscères sont associées aux nerfs sympathiques et parasympathiques. La majorité des organes viscéraux sont innervés par le nerf vagal, mais les études ne montrent pas clairement si ce nerf est capable ou non de transporter une entrée afférente nociceptive. Cependant, certaines études démontrent clairement que les afférences vagales transmettent des informations sur les stimuli mécaniques de haute intensité au système nerveux central. Un certain nombre d’études impliquant des humains ou des animaux ont montré que les sujets atteints d’une lésion de la corne vertébrale peuvent signaler une douleur provenant probablement de la région des organes viscéraux.
- 1.0 1.1 Loeser JD, Treede RD. Le protocole de Kyoto de la terminologie de base de la douleur de l’IASP. La douleur. 2008; 137 (3): 473–7. doi: 10.1016 / j.pain.2008.04.025. PMID 18583048
- Basbaum AI, Jessell T. La perception de la douleur. Dans: Kandel ER, Schwartz J, Jessell T. éditeurs. Principes de la neuroscience. New York: Appleton et Lange; 2000. p472-491
- 3,0 3,1 3,2 3,3 3,4 3,5 Meyer RA, Ringkamp M, Campbell JN, Raja SN. Mécanismes périphériques de la nociception cutanée. Dans: McMahon SB, Koltzenburg M, éditeurs. Wall et Melzack’s Textbook of Pain. Londres: Elsevier; 2006. p3–34.
- Lloyd DPC. Modèles de neurones contrôlant la transmission des réflexes ipsilatéraux des membres postérieurs chez le chat. J Neurophysiol. 1943; 6: 293–315
- 5,0 5,1 5,2 Schaible HG, Schmidt RF. Effets d’une arthrite expérimentale sur les propriétés sensorielles des unités afférentes articulaires fines. Journal de neurophysiologie. 1985; 54: 1109-1122
- Häbler HJ, Jänig W, Koltzenburg M.Un nouveau type de nocicepteur chimiosensible non myélinisé dans la vessie extrêmement enflammée. Agents et actions. 1988; 25: 219-221
- Tanelian DL. Activation cholinergique d’une population de nerfs afférents cornéens. Recherche expérimentale sur le cerveau. 1991; 86: 414-420
- LaMotte RH, Campbell JN. Comparaison des réponses des afférents de fibres C chaudes et nociceptives chez le singe avec les jugements humains de la douleur thermique. Journal de neurophysiologie. 1978; 41: 509-528
- Treede RD, Meyer RA, Raja SN, Campbell JN. Preuve de deux mécanismes de transduction thermique différents dans les afférences primaires nociceptives innervant la peau de singe. Journal de physiologie. 1995; 483: 747-758
- Schepers RJ, Ringkamp M. Thermorécepteurs et afférents thermosensibles. Neuroscience & Examens biocomportementaux. 2010; 34 (2): 177-184
- Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. Le récepteur de la capsaïcine: un canal ionique activé par la chaleur dans la voie de la douleur. Nature 1997; 389: 816–824
- Bjur D, Alfredson H, Forsgren S. Le modèle d’innervation du tendon d’Achille humain: études du tendon normal et tendineux avec des marqueurs d’innervation générale et sensorielle. Cell Tissue Res. 2005; 320: 201-206
- 13,0 13,1 Ashton IK, Ashton BA, Gibson SJ, Polak JM, Jaffray DC, Eisenstein SM. Base morphologique du mal de dos: la mise en évidence de fibres nerveuses et de neuropeptides dans la capsule articulaire de la facette lombaire mais pas dans le ligament fl avum. J Orthop Res. 1992; 10 (1): 72-78
- Kiter E, Karaboyun T, Tufan AC, Acar K. ImmunohistochemicalfckLR Démonstration des terminaisons nerveuses libres dans le ligament iliolombaire. La colonne vertébrale. 2010; 35 (4): E101-4. doi: 10.1097 / BRS.0b013e3181ae561d.
- Hirsch C, Ingelmark BE, Miller M. La base anatomique de la lombalgie. Études sur la présence de terminaisons nerveuses sensorielles dans les structures des disques ligamentaires, capsulaires et intervertébraux dans le rachis lombaire humain. Acta Orthop Scand. 1963; 33: 1–17.
- Moller, Aage (22/04/2014). La douleur, son anatomie, sa physiologie et son traitement. Édition Kindle.
