Nociceptoren kunnen worden geactiveerd door drie soorten prikkels in het doelweefsel: temperatuur (thermisch), mechanisch (bijvoorbeeld rek / spanning) en chemisch (bijvoorbeeld pH-verandering als gevolg van een lokaal ontstekingsproces). Zo kan een schadelijke stimulus worden onderverdeeld in een van deze drie groepen.
De termen nociceptie en pijn mogen niet als synoniemen worden gebruikt, omdat ze allemaal kunnen voorkomen zonder de ander. Pijn die ontstaat door activering van de nociceptoren wordt nociceptieve pijn genoemd. Nociceptieve pijn kan worden geclassificeerd volgens het weefsel waarin de nociceptoractivering plaatsvond: oppervlakkig somatisch (bijv. Huid), diep somatisch (bijv. Ligamenten / pezen / botten / spieren) of visceraal (inwendige organen).
Nociception pathway
Niet elke nociceptor reageert op elk type van schadelijke stimuli. Het klaarblijkelijke gebrek aan een reactie op een schadelijke stimulus kan het gevolg zijn van verschillende receptoren die zich op het membraan van de eindterminal bevinden (vrije zenuwuiteinden) of de stimulusintensiteit is onvoldoende. Gewoonlijk ligt de stimulatiedrempel van een nociceptor onder de weefselbeschadigende intensiteit. Nociceptoren hebben heterogene eigenschappen en reageren op meerdere stimulusmodaliteiten (polymodaal). De toepassing van een schadelijke stimulus van één modaliteit kan echter de responseigenschappen van de nociceptor op andere modaliteiten veranderen. Ook kan de toepassing van een bepaalde stimulus gedurende een bepaalde tijd langdurige veranderingen in de responseigenschappen van de nociceptor veroorzaken. Letsels en ontstekingen verlagen de drempelwaarde en vergroten de omvang van de respons op een bepaalde stimulus, een fenomeen dat bekend staat als perifere sensibilisatie. Van bijzonder belang zijn de op warmte reagerende, maar mechanisch ongevoelige niet-gemyeliniseerde afferenten die alleen mechanische gevoeligheid ontwikkelen in de setting van letsel.
Nociceptoren hebben het morfologische uiterlijk van vrije zenuwuiteinden. De term “vrije zenuwuiteinden” geeft aan dat in de lichtmicroscoop geen (corpusculaire) receptieve structuur kan worden herkend. Momenteel zijn er geen duidelijke ultrastructurele verschillen tussen niet-nociceptieve vrije zenuwuiteinden (bijv. Gevoelige mechanoreceptoren en thermoreceptoren) en nociceptieve. . Functioneel verschillende vrije zenuwuiteinden
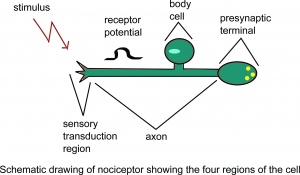
Schematische tekening van nociceptor met de vier regio’s van de cel.
worden verondersteld verschillende sets receptormoleculen in hun axonale membraan te bezitten. Receptormoleculen die bijzonder belangrijk zijn voor de functie van spiernociceptoren zijn zuurgevoelige ionenkanalen (ASIC’s) die openen bij een lage weefsel-pH, P2X3-receptoren die worden geactiveerd door binding van adenosinetrifosfaat (ATP), en het transient receptorpotentiale receptorsubtype 1 (TRPV1) dat gevoelig is voor hoge temperaturen, capsaïcine-chemische stoffen en lage pH. neuropeptidestof P heeft gemeld voornamelijk aanwezig te zijn in nociceptieve afferente vezels. Hoewel er talrijke neurotransmitters in het zenuwstelsel zijn, zijn de drie meest voorkomende die deelnemen aan nociceptieve overdracht peptiden, purines en exciterende aminozuren (EAA). De EAA, in het bijzonder glutamaat, produceert de initiële prikkelende respons op het postsynaptische, tweede-orde neuron, gevolgd door de afgifte van peptiden, waaronder stof P, wat een langere depolarisatie en aanhoudende nociceptieve transmissie veroorzaakt
Nociceptoren zijn aanwezig in veel lichaamsweefsels, maar zijn niet gevonden in gewrichtskraakbeen, viscerale pleura, longparenchym, hartzakje, hersenen en navelstrengweefsel.
Soorten nociceptoren
Verschillende klassen van nociceptoren zijn beschreven. Sommige nociceptoren reageren op schadelijke kou, schadelijke hitte en hoogdrempelige mechanische prikkels, evenals op een verscheidenheid aan chemische mediatoren. Nociceptoren, hoewel polymodaal, kunnen verder worden onderverdeeld in twee hoofdklassen op basis van respons op mechanische stimuli, wat leidt tot een onderscheid tussen mechanisch gevoelige afferenten (MSA) en mechanisch ongevoelige afferenten (MIA), gedefinieerd als afferenten met zeer hoge mechanische drempels of reageren niet op mechanische stimuli.
Nociceptoren kunnen worden geclassificeerd op basis van de geleidingssnelheid van hun axonen of vezeldiameter, dit is respectievelijk groep III en IV of Aδ en C.
Type Aδ gemyeliniseerde afferenten met gemiddelde diameter die acute, goed gelokaliseerde, scherpe prikkende pijn mediëren, bekend als groep III afferent. Aδ afferente vezels hebben een gemiddelde vezeldiameter van 2-5 mm en een geleidingssnelheid van 5-30 m / s. Aδ nociceptoren kunnen verder worden onderverdeeld in twee typen (het lijkt ongeveer 50% van elk type te bestaan)
- Type I Aδ zijn mechanisch gevoelige afferenten (MSA) die reageren met een langzaam aanpassende ontlading aan sterke accentueren druk.Ze reageren ook op warmte en chemische prikkels en hebben relatief hoge warmtedrempels (> 50C).
- Type II Aδ-nociceptoren hebben een lagere warmtedrempel dan Type I-units, maar hebben zeer hoge mechanische drempels (mechanisch ongevoelige afferenten genoemd – MIA’s). De activiteit van deze afferent medieert vrijwel zeker de “eerste” acute pijnreactie op schadelijke hitte. Ze zijn gemeld in het kniegewricht, de ingewanden en het hoornvlies.
Type C niet-gemyeliniseerde afferente vezels die slecht gelokaliseerde saaie, brandende, zogenaamde “tweede” of langzame pijn staan bekend als groep IV. De gemiddelde vezeldiameter is kleiner dan 2 mm en de geleidingssnelheid is 2 m / s of minder. De niet-gemyeliniseerde C-vezels zijn ook heterogeen. Afferente C-vezels kunnen worden onderverdeeld in twee klassen op basis van hun reactie op mechanische stimuli. Net als de gemyeliniseerde afferente Aδ-vezels, zijn de meeste C-vezels polymodaal, dat wil zeggen dat ze een populatie bevatten die zowel mechanisch als warmtegevoelig is (CMH’s). De respons van CMH’s wordt ook sterk beïnvloed door de stimulusgeschiedenis. Zowel vermoeidheid als sensibilisatie worden waargenomen. Een afname van de reactie op warmte wordt ook waargenomen na mechanische stimuli die op het receptieve veld worden uitgeoefend of elektrische stimuli die op de zenuwstam worden uitgeoefend. Dit suggereert dat vermoeidheid als reactie op een bepaalde stimulusmodaliteit kan worden geïnduceerd door heterologe stimulatie, dat wil zeggen door excitatie met een stimulus van een andere modaliteit. Dit zijn het overheersende type C-vezel nociceptoren in de huid van zoogdieren. Mechanisch ongevoelige C-vezels (C-MIA’s) reageren niet op mechanische prikkels of hebben een zeer hoge mechanische drempel. Deze afferenten reageren op hitte en verschillende schadelijke chemische stimuli (bijv. Capsaïcine, histamine) en worden vaak als chemoreceptoren beschouwd.
Samenvattend is een onmiddellijke, goed gelokaliseerde, gierige pijnsensatie gemedieerd door gemyeliniseerde zenuwvezels met een kleine diameter, type Aδ. C-vezels mediëren slecht gelokaliseerde anatomisch soort pijn, het heeft een pijnlijk en branderig karakter, komt later dan de eerste eerste sensatie en het is moeilijk om de kracht ervan in te schatten.
TRP-kanalen
Nociceptoren reageren op een bepaald temperatuurbereik en mechanische prikkels.
Het perifere uiteinde van het axon bevat ingekapselde eiwitten die transductie-eiwitten (TRP) worden genoemd en die kunnen worden geactiveerd door een specifieke stimulus. De transient receptor potential (TRP) multigene superfamilie codeert voor integrale membraaneiwitten die functioneren als ionenkanalen. De TRP-kanaalfamilie is van belang omdat verschillende leden betrokken zijn bij nociceptorsignaaltransductie.
Schadelijke koude en schadelijke warmtestimuli worden gedetecteerd door Aδ- en C-vezelnociceptoren. De TRP-kanaalfamilie biedt een groep moleculen die zijn uitgerust om thermische veranderingen te detecteren. Het volledige temperatuurbereik, van schadelijke kou tot schadelijke hitte, lijkt te worden getransduceerd door de activiteit in deze ionenkanalen. TRPM8 en TRPV3 / 4 coderen respectievelijk voor koel en warm, TRPA1 transduceert schadelijke kou en TRPV1 / 2 voelt schadelijke warmte. Sommige van de voor warmte gevoelige TRP-kanalen reageren ook op chemische en mechanische stimuli.
TRPV1 is bijvoorbeeld essentieel voor het transduceren van het nociceptieve door inflammatoire en hypothermische effecten van vanilloïde verbindingen en draagt bij aan acute thermische nociceptie en thermische hyperalgesie na weefselschade. TRPV1-stroom wordt versterkt door bradykinine en zenuwgroeifactor via verschillende mogelijke mechanismen en wordt ook geactiveerd door protonen en capsaïcine, de ‘‘ hete ’verbinding in chilipepers. In tegenstelling tot de hyperalgesie na intense schadelijke stimuli, kan langdurige blootstelling aan capsaïcine resulteren in desensibilisatie.
Hoewel de ontdekking van warmtegevoelige TRP-kanalen ons begrip van transductiemechanismen van thermische stimuli aanzienlijk heeft verbeterd, zijn bevindingen bij dieren met selectieve gendeleties duidelijk geven aan dat meerdere en nog onbekende transductiemechanismen worden gebruikt door thermische stimuli.
Chemische mediatoren
Letsel resulteert in de lokale afgifte van talrijke chemicaliën uit niet-neuronale cellen (bijv. fibroblasten, mestcellen, neutrofielen, monocyten en bloedplaatjes), evenals uit de sensorische uiteinden van primaire afferente vezels die het ontstekingsproces bemiddelen of vergemakkelijken. Ontstekingsmediatoren omvatten prostaglandinen, leukotriënen, bradykinine, serotonine, histamine, SP, tromboxanen, bloedplaatjes-activerende factor, purines zoals adenosine en ATP, protonen en vrije radicalen. Cytokinen, zoals interleukinen en tumornecrosefactor, en neurotrofinen, vooral NGF, worden ook gegenereerd tijdens ontsteking.Het is vermeldenswaard dat van de meeste van deze chemicaliën (voornamelijk stoffen zoals bradykinine en prostaglandine E2) over het algemeen wordt aangenomen dat ze nociceptoren niet direct activeren, maar eerder het gevoel van pijn versterken als reactie op natuurlijke stimuli en andere endogene chemicaliën door de werkingsfrequentie te verhogen. mogelijk afvuren.
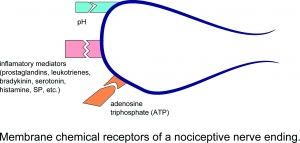
Membraan-chemische receptoren van een nociceptieve zenuwuiteinde.
Activering van nociceptoren zendt niet alleen afferente berichten naar de dorsale hoorn van het ruggenmerg, maar start ook het proces van neurogene ontsteking. Neurogene ontsteking veroorzaakt het vrijkomen van neurotransmitters, met name stof P en calcitonine-gen-gerelateerd peptide (CGRP), wat leidt tot ernstige vasodilatatie, evenals plasmalekkage van eiwitten en vloeistof uit postcapillaire venulen.
Twee chemicaliën zijn van bijzonder belang:
- Adenosinetrifosfaat (ATP)
ATP is het energiedragende molecuul in alle cellen van het lichaam. Het komt vrij uit alle weefsels tijdens trauma en andere pathologische veranderingen die verband houden met celdood. Om deze reden wordt ATP beschouwd als een algemene signaalstof voor weefseltrauma en pijn. In microneurografische onderzoeken bij mensen activeerde injectie van ATP 60% van de mechano-responsieve en mechano-ongevoelige C-nociceptieve vezels zonder deze vezels gevoelig te maken voor mechanische of warmtestimuli. ATP activeert purinerge P2X3-receptoren in nociceptoren en veroorzaakt een ontlading. ATP is vooral belangrijk bij spierpijn omdat het in hoge concentratie in spiercellen aanwezig is.
- Protonenveranderingen in de pH van het weefsel
Zuurgevoelige ionenkanalen (ASIC’s) vormen een familie van receptormoleculen die gevoelig zijn voor een daling van de pH en openen bij verschillende pH-waarden. De kanaaleiwitten reageren al te kleine pH-veranderingen. Deze receptorfamilie (bijvoorbeeld ASIC1 en ASIC3) is vooral belangrijk voor spierpijn omdat bijna alle pathologische veranderingen in de spier gepaard gaan met een daling van de weefsel-pH, bijvoorbeeld uitputtende inspanning, ischemie en ontsteking.
Locatie van nociceptoren
De cellichamen van nociceptoren bevinden zich in de dorsale wortelganglia (DRG) voor de periferie en het trigeminale ganglion voor het gezicht. Hun axonen strekken zich uit tot in het perifere zenuwstelsel en eindigen in takken die receptieve velden creëren.
- Huid
Vrije zenuwuiteinden die eindigen in de huid zijn de machinerie voor het signaleren van lokale mechanische, thermische en chemische veranderingen. De grote meerderheid van vrije zenuwuiteinden in de huid worden polymodale nociceptoren genoemd omdat ze meerdere receptoren bevatten en dus reageren op verschillende combinaties van de bovengenoemde stimulus. Type I Aδ hoogdrempelige mechanoreceptoreneenheden zijn dicht verdeeld in harige en gladde huid.
- Spieren
Receptormoleculen die bijzonder belangrijk zijn voor de functie van spiernociceptoren zijn zuurgevoelige ionenkanalen (ASIC’s) die openen bij een lage weefsel-pH, P2X3-receptoren die worden geactiveerd door binding van adenosinetrifosfaat (ATP), en het transiënte receptorpotentieel receptorsubtype 1 (TRPV1) dat gevoelig is voor hoge temperaturen en lage pH.
In skeletspieren lijken de vrije zenuwuiteinden vrij gelijkmatig te zijn verdeeld. Er werd geen verschil gevonden tussen de proximale en distale delen van de gastrocnemius-soleus-spier bij de rat. In hetzelfde onderzoek bleek echter dat de zenuwvezeldichtheid in het peritendineum van de calcaneale pees van de rat verschillende keren hoger was dan die in de GS-spier. Daarentegen waren de collageenvezelbundels van het eigenlijke peesweefsel bijna vrij van vrije zenuwuiteinden.
- Tendons
Innervatie van de menselijke achillespees wordt geleverd door zenuwen van de omliggende spieren en door kleine fasciculi van huidzenuwen, maar dit omvat alle zenuwuiteinden. Vrije zenuwuiteinden zijn vertegenwoordigd in de pezen, maar voornamelijk in peritendineus weefsel zijn pijnreceptoren. Het aantal en de locatie van alle zenuwvezels en zenuwuiteinden variëren afhankelijk van de functie van de pees, en zijn meer vertegenwoordigd in de kleinere pezen die betrokken zijn bij fijne bewegingen.
- Gewricht
Nociceptoren in gewrichten bevinden zich in het gewrichtskapsel, ligamenten en proximale pezen, botten, periosteum, gewrichtsvetkussentjes en rond bloedvaten, maar niet in het gewrichtskraakbeen. Hoogdrempelige nociceptieve afferenten eindigen voornamelijk in het synovium en periost en reageren normaal gesproken alleen op de beweging van het gewricht buiten de werkgrenzen. Na gewrichtsschade combineren twee factoren de mechanische gevoeligheid van articulaire nociceptoren.Ten eerste veranderen fysieke veranderingen (gewrichtseffusie en weefseloedeem) de rust- en bewegingskrachten die op de gewrichtsweefsels worden uitgeoefend, en ten tweede maken ontstekingsmediatoren die vrijkomen in het beschadigde weefsel de articulaire nociceptieve afferenten gevoelig door zich te binden aan receptoren op de zenuwuiteinden. Veel nociceptoren van het gewricht reageren op onschadelijke bewegingen, maar worden in toenemende mate geactiveerd wanneer bewegingen het fysiologische werkbereik overschrijden, terwijl andere nociceptoren uitsluitend actief zijn tijdens schadelijke bewegingen. De derde groep van zogenaamde stille nociceptoren is normaal gesproken inactief en reageert alleen onder pathologische omstandigheden zoals ontsteking.
Het is aangetoond dat het lumbale facetgewrichtskapsel rijkelijk wordt geïnnerveerd door nociceptoren en proprioceptieve vezels. In een normale toestand hebben nociceptoren, zoals die worden gezien in het facetgewrichtskapsel, een hoge drempel en wordt niet verwacht dat ze worden ontladen tenzij de belasting suprafysiologisch is. In de aanwezigheid van pathologische gewrichtsontsteking kunnen chemische mediatoren van synovitis deze nociceptoren echter sensibiliseren en is het mogelijk dat suprafysiologische stressniveaus niet langer nodig zijn om pijn te stimuleren. Dergelijke ontstekingsmediatoren (stof P, bradykinine, fosfolipase A2) zijn gedetecteerd in het facetgewrichtskapsel.
Nociceptoren in tussenwervelschijven zijn normaal gesproken beperkt tot het buitenste derde deel van de annulus, en kunnen het substraat zijn voor discogene pijn wanneer ze worden uitgebreid over het grotere ringvormige gebied en verder doordringen in de gedegenereerde schijf langs het vaatstelsel en de fi suren. Die C- en A δ-vezels zijn waarschijnlijk verantwoordelijk voor het overbrengen van pijnreacties. Het achterste longitudinale ligament en de buitenste annulus fi brosuslagen van de tussenwervelschijf bevatten veel nociceptieve vezels. Zenuwvezels en zenuwuiteinden komen ook voor in het subchondrale bot van de zygapofysiale gewrichten. Ze komen voor in erosiekanalen die zich uitstrekken van het subchondrale bot tot het gewrichtskraakbeen.
Een humane studie door (Kiter et al., 2010) toonde zowel vrije als ingekapselde zenuwuiteinden in het menselijke iliolumbale ligament. Studie door (Hirsch et al., 1963) suggereerde de aanwezigheid van fijne zenuwvezels en complexe niet-ingekapselde uiteinden in de supraspinale en intraspinale ligamenten.
- Viscera
Viscerale nociceptoren reageren niet op snij- of brandwonden zoals hun tegenhangers in het perifere huidweefsel. In plaats daarvan worden ze geactiveerd als reactie op pathologische veranderingen. Pijnproducerende prikkels in de ingewanden, waaronder tractie op het mesenterium, ontsteking, uitzetting van holle spierwandorganen zoals het maagdarmkanaal, de urinewegen, de galblaas en sterke samentrekkingen van de spierlagen die dergelijke holle organen omringen, irriterende chemicaliën of ischemie in organen zoals de hart. De verdeling van deze vezels varieert tussen orgels. Hoogdrempelige receptoren innerveren uitsluitend organen waarvan pijn de enige bewuste gewaarwording is (dwz urineleider, nier, longen, hart), maar zijn relatief weinig in organen die onschadelijke en schadelijke gewaarwordingen geven (bijv. Karteldarm, maag en blaas), voornamelijk geïnnerveerd door laagdrempelige receptoren. Organen, zoals de lever, longen, nieren en alvleesklier, hebben weinig receptoren, maar de pijn van deze organen komt vooral door de activering van receptoren in de capsules van deze organen. Nociceptieve stimulatie van de ingewanden leidt tot diffuse pijn die moeilijk te lokaliseren is. Afferente nociceptieve vezels in ingewanden worden gevonden in associatie met sympathische en parasympathische zenuwen. De meerderheid van de viscerale organen wordt geïnnerveerd door de nervus vagus, maar studies tonen niet duidelijk aan of deze zenuw al dan niet in staat is om nociceptieve afferente input te dragen. Sommige onderzoeken tonen echter duidelijk aan dat vagale afferenten informatie over mechanische stimuli met hoge intensiteit naar het centrale zenuwstelsel overbrengen. Een aantal studies waarbij mensen of dieren betrokken zijn, heeft aangetoond dat personen met coronaire laesie in staat zijn om pijn te melden die waarschijnlijk afkomstig is van het gebied van de viscerale organen.
- 1.0 1.1 Loeser JD, Treede RD. Het Kyoto-protocol van IASP Basic Pain Terminology. Pijn. 2008; 137 (3): 473-7. doi: 10.1016 / j.pain.2008.04.025. PMID 18583048
- Basbaum AI, Jessell T. The Perception of Pain. In: Kandel ER, Schwartz J, Jessell T. redacteuren. Principes van neurowetenschappen. New York: Appleton en Lange; 2000. p472-491
- 3,0 3,1 3,2 3,3 3,4 3,5 Meyer RA, Ringkamp M, Campbell JN, Raja SN. Perifere mechanismen van cutane nociceptie. In: McMahon SB, Koltzenburg M, redacteuren. Wall and Melzacks Textbook of Pain. Londen: Elsevier; 2006. p3-34.
- Lloyd DPC. Neuronpatronen die de overdracht van ipsilaterale achterbeenreflexen bij katten regelen. J Neurophysiol. 1943; 6: 293-315
- 5,0 5,1 5,2 Schaible HG, Schmidt RF. Effecten van een experimentele artritis op de sensorische eigenschappen van fijne articulaire afferente eenheden. Journal of Neurophysiology. 1985; 54: 1109-1122
- Häbler HJ, Jänig W, Koltzenburg M.Een nieuw type niet-gemyeliniseerde chemogevoelige nociceptor in de acuut ontstoken urineblaas. Agenten en acties. 1988; 25: 219-221
- Tanelian DL. Cholinerge activering van een populatie van cornea-afferente zenuwen. Experimenteel hersenonderzoek. 1991; 86: 414-420
- LaMotte RH, Campbell JN. Vergelijking van reacties van warme en nociceptieve C-vezel-afferenten bij apen met menselijke oordelen van thermische pijn. Journal of Neurophysiology. 1978; 41: 509-528
- Treede RD, Meyer RA, Raja SN, Campbell JN. Bewijs voor twee verschillende warmtetransductiemechanismen in nociceptieve primaire afferenten die de apenhuid innerveren. Journal of Physiology. 1995; 483: 747-758
- Schepers RJ, Ringkamp M. Thermoreceptors en warmtegevoelige afferenten. Neurowetenschappen & Biologische gedragsbeoordelingen. 2010; 34 (2): 177-184
- Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. De capsaïcine-receptor: een door warmte geactiveerd ionenkanaal in het pijnpad. Nature 1997; 389: 816-824
- Bjur D, Alfredson H, Forsgren S. Het innervatiepatroon van de menselijke achillespees: studies van de normale en tendinosepees met markers voor algemene en sensorische innervatie. Cell Tissue Res. 2005; 320: 201-206
- 13.0 13.1 Ashton IK, Ashton BA, Gibson SJ, Polak JM, Jaffray DC, Eisenstein SM. Morfologische basis voor rugpijn: het aantonen van zenuwvezels en neuropeptiden in het lumbale facetgewrichtskapsel maar niet in ligamentum fl avum. J Orthop Res. 1992; 10 (1): 72-78
- Kiter E, Karaboyun T, Tufan AC, Acar K. ImmunohistochemicalfckLR demonstratie van vrije zenuwuiteinden in iliolumbale ligament. Wervelkolom. 2010; 35 (4): E101-4. doi: 10.1097 / BRS.0b013e3181ae561d.
- Hirsch C, Ingelmark BE, Miller M. De anatomische basis voor lowfckLR-rugpijn. Onderzoek naar de aanwezigheid van sensorische zenuwuiteinden in de ligamenteuze, capsulaire en tussenwervelschijfstructuren in de lumbale wervelkolom van de mens. Acta Orthop Scand. 1963; 33: 1-17.
- Moller, Aage (2014-04-22). Pijn, de anatomie, fysiologie en behandeling. Kindle-editie.
