I nocicettori possono essere attivati da tre tipi di stimoli all’interno del tessuto bersaglio: temperatura (termico), meccanico (es. Allungamento / deformazione) e chimico (es. Variazione del pH come risultato del processo infiammatorio locale). Pertanto, uno stimolo nocivo può essere classificato in uno di questi tre gruppi.
I termini nocicezione e dolore non dovrebbero essere usati come sinonimi, perché ciascuno può verificarsi senza l’altro. Il dolore derivante dall’attivazione dei nocicettori è chiamato dolore nocicettivo. Il dolore nocicettivo può essere classificato in base al tessuto in cui si è verificata l’attivazione dei nocicettori: somatico superficiale (es. Pelle), somatico profondo (es. Legamenti / tendini / ossa / muscoli) o viscerale (organi interni).
Percorso della nocicezione
Non tutti i nocicettori rispondono a ciascun tipo di stimoli nocivi. L’apparente mancanza di una risposta a uno stimolo nocivo può derivare a causa di diversi recettori situati sulla membrana del terminale terminale (terminazione nervosa libera) o l’intensità dello stimolo è insufficiente. Di solito, la soglia di stimolazione di un nocicettore è inferiore all’intensità dannosa per i tessuti. I nocicettori hanno proprietà eterogenee, rispondendo a molteplici modalità di stimolo (polimodale). Tuttavia, l’applicazione di stimoli nocivi di una modalità può alterare le proprietà di risposta del nocicettore ad altre modalità. Inoltre, l’applicazione di un particolare stimolo per un dato periodo di tempo può indurre cambiamenti a lungo termine nelle proprietà di risposta del nocicettore. Lesioni e infiammazioni riducono la soglia e aumentano l’entità della risposta per un dato stimolo, un fenomeno noto come sensibilizzazione periferica. Di particolare interesse sono le afferenze non mielinizzate che rispondono al calore, ma meccanicamente insensibili, che sviluppano sensibilità meccanica solo nel contesto della lesione.
I nocicettori hanno l’aspetto morfologico di terminazioni nervose libere. Il termine “terminazione nervosa libera” indica che nel microscopio ottico non è possibile riconoscere alcuna struttura ricettiva (corpuscolare). Allo stato attuale, non ci sono chiare differenze ultrastrutturali tra terminazioni nervose libere non nocicettive (es. Meccanocettori sensibili e termocettori) e nocicettive . Funzionalmente, diverse terminazioni nervose libere
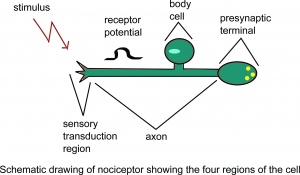
Disegno schematico del nocicettore che mostra il quattro regioni della cellula.
si presume possiedano diversi set di molecole recettoriali nella loro membrana assonale. Le molecole recettoriali che sono particolarmente importanti per la funzione dei nocicettori muscolari sono canali ionici sensibili all’acido (ASIC) che si aprono a un pH tissutale basso, recettori P2X3 attivati legando l’adenosina trifosfato (ATP) e il recettore potenziale transitorio sottotipo 1 (TRPV1) sensibile alle alte temperature, alla capsaicina chimica e al pH basso. la sostanza neuropeptidica P ha è stato segnalato che è presente prevalentemente nelle fibre afferenti nocicettive. Sebbene ci siano numerosi neurotrasmettitori all’interno del sistema nervoso, i tre più comuni che partecipano alla trasmissione nocicettiva sono i peptidi, le purine e gli amminoacidi eccitatori (EAA). Gli EAA, in particolare il glutammato, producono la risposta eccitatoria iniziale sul neurone postsinaptico, di secondo ordine, seguita dal rilascio di peptidi, inclusa la sostanza P, provocando una depolarizzazione più prolungata e una trasmissione nocicettiva sostenuta
Sono presenti nocicettori in molti tessuti del corpo, ma non sono stati trovati nella cartilagine articolare, nella pleura viscerale, nel parenchima polmonare, nel pericardio, nel cervello e nel tessuto cordonale.
Tipi di nocicettori
Diverse classi di sono stati descritti nocicettori. Alcuni nocicettori rispondono al freddo nocivo, al caldo nocivo e agli stimoli meccanici ad alta soglia, nonché a una varietà di mediatori chimici. I nocicettori, sebbene polimodali, possono essere ulteriormente suddivisi in due classi principali sulla base della risposta a stimoli meccanici, portando a una distinzione tra afferenze meccanicamente sensibili (MSA) e afferenti meccanicamente insensibili (MIA) definite come afferenze che hanno soglie meccaniche molto elevate o non rispondono agli stimoli meccanici.
I nocicettori possono essere classificati in base alla velocità di conduzione dei loro assoni o diametro delle fibre, questo è rispettivamente il gruppo III e IV ord Aδ e C.
Afferenze mieliniche di diametro medio di tipo Aδ che mediano il dolore di tipo acuto, ben localizzato e acuto, noto come afferente di gruppo III. Le fibre afferenti Aδ hanno un diametro medio della fibra di 2-5 mm e una velocità conduttiva di 5-30 m / s. I nocicettori Aδ possono essere ulteriormente suddivisi in due tipi (sembra esistere circa il 50% di ciascun tipo)
- Tipo I Aδ sono afferenze meccanicamente sensibili (MSA) che rispondono con una scarica che si adatta lentamente a forte punteggiare la pressione.Rispondono anche al calore e agli stimoli chimici e hanno soglie di calore relativamente elevate (> 50C).
- I nocicettori di Tipo II Aδ hanno una soglia di calore inferiore rispetto alle unità di Tipo I ma hanno soglie meccaniche molto elevate (chiamate afferenze meccanicamente insensibili – MIA). L’attività di questa afferente quasi certamente media la “prima” risposta del dolore acuto al calore nocivo. Sono stati segnalati nell’articolazione del ginocchio, nei visceri e nella cornea.
Fibre afferenti non mielinizzate di tipo C che convogliano dolore sordo, bruciante, scarsamente localizzato, cosiddetto “secondo” o lento, è noto come gruppo IV. Il diametro medio delle fibre è inferiore a 2 mm e la velocità conduttiva è pari o inferiore a 2 m / s. Anche le fibre C non mielinizzate sono eterogenee. Le afferenze della fibra C possono essere suddivise in due classi in base alla loro risposta agli stimoli meccanici. Come le fibre afferenti Aδ mielinizzate, la maggior parte delle fibre C sono polimodali, ovvero includono una popolazione che è sia meccanicamente che sensibile al calore (CMH). La risposta delle CMH è anche fortemente influenzata dalla storia dello stimolo. Si osservano sia stanchezza che sensibilizzazione. Si osserva anche una diminuzione della risposta al calore a seguito di stimoli meccanici applicati al campo ricettivo o di stimoli elettrici applicati al tronco nervoso. Ciò suggerisce che l’affaticamento in risposta a una data modalità di stimolo può essere indotto da stimolazione eterologa, cioè da eccitazione con uno stimolo di una modalità diversa. Questi sono il tipo predominante di nocicettori della fibra C nella pelle dei mammiferi. Le fibre C meccanicamente insensibili (C-MIA) non rispondono agli stimoli meccanici o hanno una soglia meccanica molto elevata. Queste afferenze rispondono al calore e a vari stimoli chimici nocivi (p. Es., Capsaicina, istamina) e sono spesso considerate chemocettori.
In sintesi di quanto sopra, la sensazione di dolore avaro, immediata, ben localizzata è mediata da fibre nervose mieliniche di piccolo diametro, tipo Aδ. Le fibre C mediano un tipo di dolore anatomicamente scarsamente localizzato, ha un carattere doloroso e bruciante, si manifesta dopo la prima sensazione iniziale ed è difficile stimarne la forza.
Canali TRP
I nocicettori rispondono a determinati intervalli di temperatura e stimoli meccanici.
L’estremità periferica dell’assone contiene proteine incapsulate chiamate proteine di trasduzione (TRP), che possono essere attivate da uno stimolo specifico. La superfamiglia multigenica del potenziale transitorio del recettore (TRP) codifica per proteine integrali di membrana che funzionano come canali ionici. La famiglia dei canali TRP è interessante perché diversi membri sono stati implicati nella trasduzione del segnale dei nocicettori.
Gli stimoli nocivi del freddo e del calore sono rilevati dai nocicettori delle fibre A e C. La famiglia di canali TRP fornisce un gruppo di molecole attrezzate per rilevare i cambiamenti termici. L’intera gamma di temperature, dal freddo nocivo al caldo nocivo, sembra essere trasdotta dall’attività in questi canali ionici. TRPM8 e TRPV3 / 4 codificano rispettivamente freddo e caldo, TRPA1 trasduce il freddo nocivo e TRPV1 / 2 rileva il calore nocivo. Alcuni dei canali TRP termosensibili rispondono anche a stimoli chimici e meccanici.
Ad esempio, TRPV1 è essenziale per trasdurre gli effetti nocicettivi infiammatori e ipotermici dei composti vanilloidi e contribuisce alla nocicezione termica acuta e all’iperalgesia termica a seguito di lesioni tissutali. La corrente TRPV1 è potenziata dalla bradichinina e dal fattore di crescita nervoso attraverso diversi possibili meccanismi ed è anche attivata dai protoni e dalla capsaicina, il composto “caldo” del peperoncino. In contrasto con l’iperalgesia a seguito di stimoli nocivi intensi, l’esposizione prolungata alla capsaicina può provocare una successiva desensibilizzazione.
Mentre la scoperta di canali TRP termosensibili ha notevolmente migliorato la nostra comprensione dei meccanismi di trasduzione degli stimoli termici, i risultati in animali con delezioni geniche selettive chiaramente indicano che meccanismi di trasduzione multipli e ancora sconosciuti sono coinvolti da stimoli termici.
Mediatori chimici
La lesione provoca il rilascio locale di numerose sostanze chimiche da cellule non neuronali (p. es., fibroblasti, mastociti, neutrofili, monociti e piastrine), nonché dai terminali sensoriali delle fibre afferenti primarie che mediano o facilitano il processo infiammatorio. I mediatori infiammatori includono prostaglandine, leucotrieni, bradichinina, serotonina, istamina, SP, trombossani, fattore di attivazione delle piastrine, purine come adenosina e ATP, protoni e radicali liberi. Durante l’infiammazione vengono generate anche citochine, come le interleuchine e il fattore di necrosi tumorale, e le neurotrofine, in particolare l’NGF.Vale la pena notare che la maggior parte di queste sostanze chimiche (principalmente sostanze come la bradichinina e la prostaglandina E2) sono generalmente considerate non attive direttamente nocicettori ma piuttosto aumentano la sensazione di dolore in risposta a stimoli naturali e altre sostanze chimiche endogene aumentando la frequenza di azione potenziale accensione.
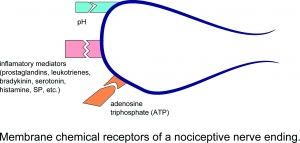
Recettori chimici di membrana di una terminazione nervosa nocicettiva.
L’attivazione dei nocicettori non solo trasmette messaggi afferenti al corno dorsale del midollo spinale, ma avvia anche il processo di infiammazione neurogena. L’infiammazione neurogena provoca il rilascio di neurotrasmettitori, in particolare la sostanza P e il peptide correlato al gene della calcitonina (CGRP), che porta a una grave vasodilatazione, nonché alla fuoriuscita plasmatica di proteine e fluidi dalle venule post-capillari.
Due sostanze chimiche sono di particolare interesse:
- Adenosina trifosfato (ATP)
L’ATP è la molecola che trasporta energia in tutte le cellule del corpo. Viene rilasciato da tutti i tessuti durante il trauma e altri cambiamenti patologici associati alla morte cellulare. Per questo motivo, l’ATP è stata considerata una sostanza segnale generale per il trauma e il dolore tissutale. Negli studi microneurografici sull’uomo, l’iniezione di ATP ha attivato il 60% delle fibre C-nocicettive meccanicamente sensibili e meccano-sensibili senza sensibilizzare queste fibre a stimoli meccanici o termici. L’ATP attiva i recettori purinergici P2X3 nei nocicettori provocando una scarica. L’ATP è particolarmente importante per il dolore muscolare perché è presente nelle cellule muscolari in alta concentrazione.
- Alterazione dei protoni nel pH dei tessuti
I canali ionici sensibili agli acidi (ASIC) costituiscono una famiglia di molecole recettoriali sensibili a un calo del pH e aperte a vari valori di pH. Le proteine del canale reagiscono a variazioni di pH già troppo piccole. Questa famiglia di recettori (ad esempio ASIC1 e ASIC3) è particolarmente importante per il dolore muscolare perché quasi tutti i cambiamenti patologici nei muscoli sono accompagnati da un calo del pH dei tessuti, ad esempio esercizio estenuante, ischemia e infiammazione.
Posizione dei nocicettori
I corpi cellulari dei nocicettori si trovano nei gangli della radice dorsale (DRG) per la periferia e nel ganglio trigemino per il viso. I loro assoni si estendono nel sistema nervoso periferico e terminano in rami creando campi recettivi.
- Pelle
Le terminazioni nervose libere che terminano nella pelle sono il meccanismo per segnalare i cambiamenti meccanici, termici e chimici locali. La grande maggioranza delle terminazioni nervose libere nella pelle sono chiamate nocicettori polimodali perché contengono più recettori e quindi rispondono a varie combinazioni dello stimolo sopra menzionato. Le unità dei meccanocettori ad alta soglia di tipo I Aδ sono densamente distribuite nella pelle pelosa e glabra.
- Muscoli
Molecole recettoriali particolarmente importanti per il funzione dei nocicettori muscolari sono i canali ionici sensibili all’acido (ASIC) che si aprono a un pH dei tessuti basso, i recettori P2X3 attivati legando l’adenosina trifosfato (ATP) e il recettore potenziale transitorio sottotipo 1 (TRPV1) che è sensibile temperature e pH basso.
Nel muscolo scheletrico, le terminazioni nervose libere sembrano essere distribuite in modo abbastanza uniforme. Non è stata trovata alcuna differenza tra le porzioni prossimale e distale del muscolo gastrocnemio-soleo di ratto. Tuttavia, nello stesso studio, la densità delle fibre nervose nel peritendineo del tendine calcaneale del ratto è risultata essere molte volte superiore a quella del muscolo GS. Al contrario, i fasci di fibre di collagene del tessuto tendineo vero e proprio erano quasi privi di terminazioni nervose libere.
- Tendini
Innervazione dei tendini di Achille umani è fornito dai nervi dei muscoli circostanti e da piccoli fascicoli dei nervi cutanei ma questo coinvolge tutte le terminazioni nervose. Le terminazioni nervose libere sono rappresentate all’interno dei tendini, ma principalmente nel tessuto peritendineo, sono recettori del dolore. Il numero e la posizione di tutte le fibre nervose e delle terminazioni nervose variano a seconda della funzione del tendine, essendo maggiormente rappresentati nei tendini più piccoli coinvolti nei movimenti fini.
- Articolazione
I nocicettori nelle articolazioni si trovano all’interno della capsula articolare, dei legamenti e dei tendini prossimali, dell’osso, del periostio, del cuscinetto adiposo articolare e intorno ai vasi sanguigni ma non nella cartilagine articolare. Le afferenze nocicettive ad alta soglia terminano principalmente nella sinovia e nel periostio e normalmente rispondono solo al movimento dell’articolazione oltre i limiti di lavoro. A seguito di un danno articolare, due fattori si combinano per alterare la sensibilità meccanica dei nocicettori articolari.In primo luogo, i cambiamenti fisici (versamento articolare ed edema tissutale) alterano le forze a riposo e indotte dal movimento esercitate sui tessuti articolari, e in secondo luogo, i mediatori infiammatori rilasciati all’interno del tessuto danneggiato sensibilizzano le afferenze nocicettive articolari legandosi ai recettori sulle terminazioni nervose. Molti nocicettori dell’articolazione rispondono a movimenti innocui ma si attivano sempre più quando i movimenti superano il range di lavoro fisiologico, mentre altri nocicettori sono attivi esclusivamente durante i movimenti nocivi. Il terzo gruppo di cosiddetti nocicettori silenti è normalmente inattivo e risponde solo in circostanze patologiche come l’infiammazione.
È stato dimostrato che la capsula articolare della faccetta lombare è riccamente innervata dai nocicettori e dalle fibre propriocettive. In uno stato normale, i nocicettori come quelli osservati nella capsula della faccetta articolare hanno una soglia elevata e non ci si aspetterebbe che si scarichino a meno che i carichi non siano sovrafisiologici. Tuttavia, in presenza di infiammazione patologica delle articolazioni, i mediatori chimici della sinovite possono sensibilizzare questi nocicettori e potrebbero non essere più necessari livelli sovrafisiologici di stress per stimolare il dolore. Tali mediatori infiammatori (sostanza P, bradichinina, fosfolipasi A2) sono stati rilevati nella capsula della faccetta articolare.
I nocicettori nei dischi intervertebrali sono normalmente limitati al terzo esterno dell’anello, potrebbero essere il substrato per il dolore discogenico quando si espandono sull’area anulare più ampia e penetrano ulteriormente nel disco degenerato lungo la vascolarizzazione e le fissazioni. Quelle fibre C e A δ sono probabilmente responsabili della trasmissione delle risposte al dolore. Il legamento longitudinale posteriore e gli strati dell’annulus fi brosus esterno del disco intervertebrale contengono molte fibre nocicettive. Le fibre nervose e le terminazioni nervose si verificano anche nell’osso subcondrale delle articolazioni zigapofisarie. Si verificano nei canali di erosione che si estendono dall’osso subcondrale alla cartilagine articolare.
Uno studio sull’uomo di (Kiter et al., 2010) ha mostrato terminazioni nervose sia libere che incapsulate nel legamento iliolombare umano. Lo studio di (Hirsch et al., 1963) ha suggerito la presenza di fibre nervose fini e terminazioni complesse non incapsulate nei legamenti sovraspinosi e intraspinali.
- Viscera
I nocicettori viscerali non rispondono a lesioni da taglio o bruciore come le loro controparti nel tessuto cutaneo periferico. Invece, vengono attivati in risposta al cambiamento patologico. Stimoli che producono dolore nei visceri, inclusa trazione sul mesentere, infiammazione, distensione degli organi cavi con pareti muscolari come gastrointestinale, tratto urinario, cistifellea e forti contrazioni degli strati muscolari che circondano tali organi cavi, sostanze chimiche irritanti o ischemia in organi come cuore. La distribuzione di queste fibre varia tra gli organi. I recettori ad alta soglia innervano esclusivamente gli organi da cui il dolore è l’unica sensazione cosciente (cioè uretere, reni, polmoni, cuore), ma sono relativamente pochi negli organi che forniscono sensazioni innocue e nocive (p. Es., Colon, stomaco e vescica), innervato principalmente da recettori a bassa soglia. Gli organi, come il fegato, i polmoni, i reni e il pancreas, hanno pochi recettori, ma il dolore di questi organi deriva principalmente dall’attivazione dei recettori nelle capsule di questi organi. La stimolazione nocicettiva dei visceri porta a un dolore diffuso che è difficile da localizzare. Le fibre nocicettive afferenti nei visceri si trovano in associazione con i nervi simpatico e parasimpatico. La maggior parte degli organi viscerali è innervata dal nervo vagale, ma gli studi non mostrano chiaramente se questo nervo è in grado di trasportare input afferenti nocicettivi. Tuttavia, alcuni studi dimostrano chiaramente che le afferenze vagali trasmettono informazioni sugli stimoli meccanici ad alta intensità al sistema nervoso centrale. Numerosi studi condotti su esseri umani o animali hanno dimostrato che i soggetti con lesione del midollo spinale sono in grado di segnalare il dolore probabilmente originato dall’area degli organi viscerali.
- 1.0 1.1 Loeser JD, Treede RD. Il protocollo di Kyoto della IASP Basic Pain Terminology. Dolore. 2008; 137 (3): 473–7. doi: 10.1016 / j.pain.2008.04.025. PMID 18583048
- Basbaum AI, Jessell T. The Perception of Pain. In: Kandel ER, Schwartz J, Jessell T. editori. Principi di neuroscienza. New York: Appleton e Lange; 2000. p472-491
- 3.0 3.1 3.2 3.3 3.4 3.5 Meyer RA, Ringkamp M, Campbell JN, Raja SN. Meccanismi periferici della nocicezione cutanea. In: McMahon SB, Koltzenburg M, editori. Wall e il libro di testo del dolore di Melzack. Londra: Elsevier; 2006. p3–34.
- Lloyd DPC. Pattern neuronali che controllano la trasmissione dei riflessi degli arti posteriori omolaterali nel gatto. J Neurophysiol. 1943; 6: 293–315
- 5,0 5,1 5,2 Schaible HG, Schmidt RF. Effetti di un’artrite sperimentale sulle proprietà sensoriali delle unità afferenti articolari fini. Journal of Neurophysiology. 1985; 54: 1109-1122
- Häbler HJ, Jänig W, Koltzenburg M.Un nuovo tipo di nocicettore chemosensibile non mielinizzato nella vescica urinaria acutamente infiammata. Agenti e azioni. 1988; 25: 219-221
- Tanelian DL. Attivazione colinergica di una popolazione di nervi afferenti corneali. Ricerca sperimentale sul cervello. 1991; 86: 414-420
- LaMotte RH, Campbell JN. Confronto delle risposte delle afferenze della fibra C calda e nocicettiva nella scimmia con i giudizi umani del dolore termico. Journal of Neurophysiology. 1978; 41: 509-528
- Treede RD, Meyer RA, Raja SN, Campbell JN. Prova di due diversi meccanismi di trasduzione del calore nelle afferenze primarie nocicettive che innervano la pelle di scimmia. Journal of Physiology. 1995; 483: 747-758
- Schepers RJ, Ringkamp M. Thermoreceptors and thermosensitive afferents. Neuroscience & Biobehavioral Reviews. 2010; 34 (2): 177-184
- Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. Il recettore della capsaicina: un canale ionico attivato dal calore nella via del dolore. Nature 1997; 389: 816–824
- Bjur D, Alfredson H, Forsgren S. Il modello di innervazione del tendine di Achille umano: studi del tendine normale e tendinotico con marker di innervazione generale e sensoriale. Ricerca del tessuto cellulare 2005; 320: 201-206
- 13,0 13,1 Ashton IK, Ashton BA, Gibson SJ, Polak JM, Jaffray DC, Eisenstein SM. Base morfologica per il mal di schiena: la dimostrazione di fibre nervose e neuropeptidi nella capsula della faccetta articolare lombare ma non nel legamento fl avum. J Orthop Res. 1992; 10 (1): 72-78
- Kiter E, Karaboyun T, Tufan AC, Acar K. ImmunohistochemicalfckLRdemonstration of free nerve terminings in the iliolumbar legament. Colonna vertebrale. 2010; 35 (4): E101-4. doi: 10.1097 / BRS.0b013e3181ae561d.
- Hirsch C, Ingelmark BE, Miller M. La base anatomica per il dolore alla schiena lowfckLR. Studi sulla presenza di terminazioni nervose sensoriali nelle strutture del disco legamentoso, capsulare e intervertebrale nella colonna lombare umana. Acta Orthop Scand. 1963; 33: 1–17.
- Moller, Aage (2014-04-22). Dolore, sua anatomia, fisiologia e trattamento. Edizione Kindle.
