Nocyceptory mogą być aktywowane trzema rodzajami bodźców w tkance docelowej – temperaturowym (termicznym), mechanicznym (np. Rozciąganie / odkształcenie) i chemicznym (np. Zmiana pH w wyniku miejscowego procesu zapalnego). W ten sposób szkodliwy bodziec można podzielić na jedną z tych trzech grup.
Pojęcia nocycepcja i ból nie powinny być używane jako synonimy, ponieważ każde z nich może wystąpić bez siebie. Ból powstały w wyniku aktywacji nocyceptorów nazywany jest bólem nocyceptywnym. Ból nocyceptywny można podzielić ze względu na tkankę, w której nastąpiła aktywacja nocyceptorów: powierzchowny somatyczny (np. Skóra), głęboki somatyczny (np. Więzadła / ścięgna / kości / mięśnie) lub trzewny (narządy wewnętrzne).
Ścieżka nocycepcji
Nie każdy nocyceptor odpowiada na każdy typ szkodliwych bodźców. Pozorny brak odpowiedzi na szkodliwy bodziec może wynikać z obecności różnych receptorów na błonie końca końca (wolne zakończenie nerwowe) lub z niewystarczającej intensywności bodźca. Zwykle próg stymulacji nocyceptora jest poniżej intensywności uszkadzającej tkanki. Nocyceptory mają właściwości heterogeniczne, odpowiadając na wiele modalności bodźców (polimodalnych). Jednak zastosowanie szkodliwego bodźca jednej modalności może zmienić właściwości odpowiedzi nocyceptora na inne modalności. Również zastosowanie określonego bodźca przez określony czas może wywołać długoterminowe zmiany właściwości odpowiedzi nocyceptora. Uraz i zapalenie obniżają próg i zwiększają wielkość odpowiedzi na dany bodziec, zjawisko znane jako uczulenie obwodowe. Szczególnie interesujące są wrażliwe na ciepło, ale niewrażliwe mechanicznie, niezmielinizowane aferentne, które rozwijają wrażliwość mechaniczną tylko w przypadku urazu.
Nocyceptory mają wygląd morfologiczny wolnych zakończeń nerwowych. Termin „wolne zakończenie nerwowe” wskazuje, że w mikroskopie świetlnym nie można rozpoznać żadnej (korpuskularnej) struktury receptywnej. Obecnie nie ma wyraźnych ultrastrukturalnych różnic między nienocyceptywnymi wolnymi zakończeniami nerwowymi (np. Wrażliwe mechanoreceptory i termoreceptory) a nocyceptywnymi. . Funkcjonalnie, różne wolne zakończenia nerwowe
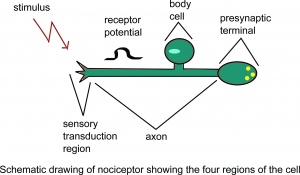
Schematyczny rysunek nocyceptora przedstawiający cztery regiony komórki.
zakłada się, że posiadają różne zestawy cząsteczek receptorów w błonie aksonalnej. Cząsteczki receptorów, które są szczególnie ważne dla funkcji nocyceptorów mięśni, to kanały jonowe wyczuwające kwas (ASIC), które otwierają się przy niskim pH tkanki, receptory P2X3, które są aktywowane przez wiązanie trifosforanu adenozyny (ATP) i przejściowy receptor potencjalnego receptora podtyp 1 (TRPV1), który jest wrażliwy na wysokie temperatury, chemiczną kapsaicynę i niskie pH. substancja neuropeptydowa P. zgłaszano występowanie głównie w nocyceptywnych włóknach doprowadzających. Chociaż istnieje wiele neuroprzekaźników w układzie nerwowym, trzy najczęściej uczestniczące w transmisji nocyceptywnej to peptydy, puryny i aminokwasy pobudzające (EAA). EAA, zwłaszcza glutaminian, wywołują początkową odpowiedź pobudzającą na neuronie postsynaptycznym drugiego rzędu, po której następuje uwolnienie peptydów, w tym substancji P, powodując dłuższą depolaryzację i utrzymujące się przenoszenie nocyceptywne
Obecne są nocyceptory w wielu tkankach ciała, ale nie stwierdzono ich w chrząstce stawowej, opłucnej trzewnej, miąższu płuc, osierdziu, mózgu i tkance pępowinowej.
Typy nocyceptorów
Kilka klas nocyceptory zostały opisane. Niektóre nocyceptory reagują na szkodliwe zimno, szkodliwe ciepło i wysokoprogowe bodźce mechaniczne, a także na różne mediatory chemiczne. Nocyceptory, chociaż polimodalne, można dalej podzielić na dwie główne klasy na podstawie odpowiedzi na bodźce mechaniczne, co prowadzi do rozróżnienia między mechanicznie wrażliwymi aferentami (MSA) i mechanicznie niewrażliwymi aferentami (MIA) zdefiniowanymi jako aferentne, które mają bardzo wysokie progi mechaniczne lub nie reagują na bodźce mechaniczne.
Nocyceptory można sklasyfikować na podstawie prędkości przewodzenia ich aksonów lub średnicy włókien, jest to odpowiednio grupa III i IV oraz Aδ i C.
Typ Aδ o średniej średnicy mielinowe doprowadzające, które pośredniczą w ostrym, dobrze zlokalizowanym, ostrym bólu typu kłucia, znanym jako aferentna grupy III. Włókna doprowadzające Aδ mają średnią średnicę 2-5 mm i prędkość przewodzenia 5-30 m / s. Nocyceptory Aδ można dalej podzielić na dwa typy (wydaje się, że istnieją w przybliżeniu 50% każdego typu)
- Typ I Aδ to mechanicznie wrażliwe aferentne (MSA), które reagują powoli dostosowującym się wyładowaniem do silnego punktowy nacisk.Reagują również na ciepło i bodźce chemiczne oraz mają stosunkowo wysokie progi ciepła (> 50 ° C).
- Nocyceptory typu II Aδ mają niższy próg ciepła niż jednostki typu I, ale mają bardzo wysokie progi mechaniczne (zwane mechanicznie niewrażliwymi aferentami – MIA). Aktywność tego doprowadzającego prawie na pewno pośredniczy w „pierwszej” ostrej odpowiedzi bólowej na szkodliwe ciepło. Zgłaszano je w stawie kolanowym, trzewiach i rogówce.
Niezmielinizowane włókna doprowadzające typu C, które przenoszą słabo umiejscowiony tępy, palący, tzw. ból „drugi” lub powolny, określane są jako grupa IV. Średnia średnica włókna wynosi poniżej 2 mm, a prędkość przewodzenia 2 m / s lub mniej. Niezmielinizowane włókna C są również niejednorodne. Aferentne włókna C można podzielić na dwie klasy w zależności od ich odpowiedzi na bodźce mechaniczne. Podobnie jak mielinowane włókna aferentne Aδ, większość włókien C jest polimodalnych, to znaczy zawierają populację wrażliwą zarówno mechanicznie, jak i na ciepło (CMH). Na odpowiedź CMH ma również duży wpływ historia bodźca. Obserwuje się zarówno zmęczenie, jak i uczulenie. Spadek odpowiedzi na ciepło obserwuje się również po zastosowaniu bodźców mechanicznych na pole recepcyjne lub bodźców elektrycznych przyłożonych do pnia nerwu. Sugeruje to, że zmęczenie w odpowiedzi na daną modalność bodźca może być wywołane stymulacją heterologiczną, to znaczy pobudzeniem bodźcem o innej modalności. Są to dominujące typy nocyceptorów włókna C w skórze ssaków. Niewrażliwe mechanicznie włókna C (C-MIA) albo nie reagują na bodźce mechaniczne, albo mają bardzo wysoki próg mechaniczny. Te doprowadzające reagują na ciepło i różne szkodliwe bodźce chemiczne (np. Kapsaicyna, histamina) i często są uważane za chemoreceptory.
Podsumowując, natychmiastowe, dobrze zlokalizowane, skąpe odczucie bólu jest za pośrednictwem mielinowych włókien nerwowych o małej średnicy typu Aδ. Włókna C pośredniczą w słabo zlokalizowanym anatomicznym typie bólu, mają charakter bolesny i piekący, pojawiają się później niż pierwsze pierwsze odczucie i trudno jest oszacować jego siłę.
Kanały TRP
Nociceptory reagują na określony zakres temperatur i bodźce mechaniczne.
Peryferyjny koniec aksonu zawiera otoczkowane białka zwane białkami transdukcyjnymi (TRP), które mogą być aktywowane przez określony bodziec. Wielogenowa nadrodzina potencjału receptorów przejściowych (TRP) koduje integralne białka błonowe, które działają jako kanały jonowe. Rodzina kanałów TRP jest interesująca, ponieważ kilku członków jest zaangażowanych w transdukcję sygnału nocyceptora.
Nocyceptory włókien Aδ i C wykrywają szkodliwe zimne i szkodliwe bodźce cieplne. Rodzina kanałów TRP zapewnia grupę cząsteczek wyposażonych w wykrywanie zmian termicznych. Wydaje się, że aktywność tych kanałów jonowych przenosi cały zakres temperatur, od szkodliwego zimna po szkodliwe ciepło. TRPM8 i TRPV3 / 4 kodują odpowiednio chłód i ciepło, TRPA1 przetwarza szkodliwe zimno, a TRPV1 / 2 wykrywa szkodliwe ciepło. Niektóre z termoczułych kanałów TRP reagują również na bodźce chemiczne i mechaniczne.
Na przykład TRPV1 jest niezbędny do transdukcji nocyceptywnych przez działanie zapalne i hipotermiczne związków waniloidowych i przyczynia się do ostrej nocycepcji termicznej i hiperalgezji termicznej po uszkodzeniu tkanki. Prąd TRPV1 jest wzmacniany przez bradykininę i czynnik wzrostu nerwów poprzez kilka możliwych mechanizmów, a także jest aktywowany przez protony i kapsaicynę, „gorący” związek w papryce chili. W przeciwieństwie do przeczulicy bólowej występującej po intensywnych, szkodliwych bodźcach, długotrwała ekspozycja na kapsaicynę może skutkować późniejszą desensytyzacją.
Chociaż odkrycie termoczułych kanałów TRP znacznie poprawiło nasze zrozumienie mechanizmów transdukcji bodźców termicznych, wyniki badań u zwierząt z selektywną delecją genów wyraźnie wskazują, że bodźce termiczne angażują liczne i jeszcze nieznane mechanizmy transdukcji.
Mediatory chemiczne
Uraz powoduje miejscowe uwalnianie wielu substancji chemicznych z komórek nieneuronalnych (np. fibroblastów, komórek tucznych, neutrofili, monocytów i płytek krwi), a także z czuciowych zakończeń pierwotnych włókien doprowadzających które pośredniczą lub ułatwiają proces zapalny. Do mediatorów zapalnych należą prostaglandyny, leukotrieny, bradykinina, serotonina, histamina, SP, tromboksany, czynnik aktywujący płytki krwi, puryny, takie jak adenozyna i ATP, protony i wolne rodniki. Podczas zapalenia powstają również cytokiny, takie jak interleukiny i czynnik martwicy nowotworów oraz neurotrofiny, zwłaszcza NGF.Warto zauważyć, że większość z tych chemikaliów (głównie substancje takie jak bradykinina i prostaglandyna E2) jest generalnie uważana za nie aktywującą bezpośrednio nocyceptorów, ale raczej wzmacniającą odczuwanie bólu w odpowiedzi na naturalne bodźce i inne endogenne chemikalia poprzez zwiększenie częstotliwości działania potencjalne odpalenie.
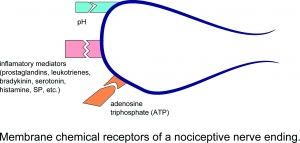
Chemiczne receptory błonowe zakończenia nerwu nocyceptywnego.
Aktywacja nocyceptorów nie tylko przekazuje aferentne informacje do rogu grzbietowego rdzenia kręgowego, ale także inicjuje proces zapalenia neurogennego. Zapalenie neurogenne powoduje uwolnienie neuroprzekaźników, w szczególności substancji P i peptydu związanego z genem kalcytoniny (CGRP), co prowadzi do poważnego rozszerzenia naczyń, a także wycieku białek i płynu z osocza z żyłek po włośniczkach.
Szczególnie interesujące są dwie substancje chemiczne:
- Adenozynotrifosforan (ATP)
ATP to cząsteczka przenosząca energię we wszystkich komórkach ciała. Jest uwalniany ze wszystkich tkanek podczas urazów i innych zmian patologicznych, które są związane ze śmiercią komórki. Z tego powodu ATP uznano za ogólną substancję sygnalizującą urazy i ból tkanki. W badaniach mikroneurograficznych na ludziach wstrzyknięcie ATP aktywowało 60% mechanicznie reagujących i niewrażliwych mechanicznie włókien C-nocyceptywnych bez uwrażliwiania tych włókien na bodźce mechaniczne lub cieplne. ATP aktywuje purynergiczne receptory P2X3 w nocyceptorach, powodując wyładowanie. ATP jest szczególnie ważny w przypadku bólu mięśni, ponieważ występuje w komórkach mięśniowych w wysokim stężeniu.
- Zmiana protonów w pH tkanki
Kanały jonowe wyczuwające kwas (ASIC) stanowią rodzinę cząsteczek receptorów wrażliwych na spadek pH i otwartych przy różnych wartościach pH. Białka kanałowe reagują już na zbyt małe zmiany pH. Ta rodzina receptorów (na przykład ASIC1 i ASIC3) jest szczególnie ważna w przypadku bólu mięśni, ponieważ prawie wszystkim patologicznym zmianom w mięśniach towarzyszy spadek pH tkanki, np. Wyczerpujący wysiłek fizyczny, niedokrwienie i stan zapalny.
Lokalizacja nocyceptorów
Ciała komórkowe nocyceptorów są zlokalizowane w zwojach korzeni grzbietowych (DRG) na obwodzie i w zwoju trójdzielnym na twarzy. Ich aksony sięgają do obwodowego układu nerwowego i kończą się gałęziami, tworząc pola recepcyjne.
- Skóra
Wolne zakończenia nerwowe kończące się w skórze są maszynerią do sygnalizowania lokalnych zmian mechanicznych, termicznych i chemicznych. Zdecydowana większość wolnych zakończeń nerwowych w skórze nazywana jest nocyceptorami polimodalnymi, ponieważ zawierają one wiele receptorów, a tym samym odpowiadają na różne kombinacje wyżej wymienionych bodźców. Wysokoprogowe jednostki mechanoreceptorów typu I Aδ są gęsto rozmieszczone w skórze owłosionej i nagiej.
- Mięśnie
Cząsteczki receptorów, które są szczególnie ważne dla funkcją nocyceptorów mięśniowych są kanały jonowe wyczuwające kwas (ASIC), które otwierają się przy niskim pH tkanki, receptory P2X3, które są aktywowane przez wiązanie trifosforanu adenozyny (ATP), oraz przejściowy receptor potencjału receptora podtyp 1 (TRPV1), który jest wrażliwy na wysokie temperatury i niskie pH.
W mięśniach szkieletowych wolne zakończenia nerwowe wydają się być rozmieszczone dość równomiernie. Nie stwierdzono różnicy między proksymalną i dystalną częścią mięśnia brzuchatego łydki i płaszczkowatego szczura. Jednak w tym samym badaniu stwierdzono, że gęstość włókien nerwowych w otrzewodzie ścięgna piętowego szczura była kilkakrotnie większa niż w mięśniu GS. W przeciwieństwie do tego, wiązki włókien kolagenowych właściwej tkanki ścięgien były prawie wolne od wolnych zakończeń nerwowych.
- Ścięgna
Wnerwienie ścięgien Achillesa człowiek jest dostarczany przez nerwy z otaczających mięśni i przez małe pęczki nerwów skórnych, ale dotyczy to wszystkich zakończeń nerwowych. Wolne zakończenia nerwowe są reprezentowane wewnątrz ścięgien, ale głównie w tkance okołościęgnowej są receptorami bólu. Liczba i umiejscowienie wszystkich włókien nerwowych i zakończeń nerwowych różni się w zależności od funkcji ścięgna i jest bardziej reprezentowana w mniejszych ścięgnach wykonujących drobne ruchy.
- Staw
Nocyceptory w stawach są zlokalizowane w torebce stawowej, więzadłach i ścięgnach proksymalnych, kościach, okostnej, poduszce tłuszczowej stawowej i wokół naczyń krwionośnych, ale nie w chrząstce stawowej. Aferentne nocyceptywne z wysokim progiem kończą się głównie w błonie maziowej i okostnej i zwykle odpowiadają tylko na ruch stawu poza granice pracy. Po uszkodzeniu stawów łączą się dwa czynniki, które zmieniają mechaniczną wrażliwość nocyceptorów stawowych.Po pierwsze, zmiany fizyczne (wysięk w stawie i obrzęk tkanek) zmieniają siły spoczynkowe i wywołane ruchem wywierane na tkanki stawu, a po drugie, mediatory zapalne uwalniane w uszkodzonej tkance uczulają nocyceptywne aferenty stawowe, wiążąc się z receptorami na zakończeniach nerwowych. Wiele nocyceptorów stawu reaguje na nieszkodliwe ruchy, ale są one coraz bardziej aktywowane, gdy ruchy przekraczają fizjologiczny zakres roboczy, podczas gdy inne nocyceptory są aktywne wyłącznie podczas ruchów szkodliwych. Trzecia grupa tzw. Cichych nocyceptorów jest normalnie nieaktywna i reaguje tylko w stanach patologicznych, takich jak zapalenie.
Wykazano, że torebka stawu lędźwiowego jest bogato unerwiona przez nocyceptory i włókna proprioceptywne. W normalnym stanie nocyceptory, takie jak te obserwowane w torebce stawu międzykręgowego, mają wysoki próg i nie oczekuje się, aby wyładowały się, chyba że obciążenia są ponadfizjologiczne. Jednakże w przypadku obecności patologicznego zapalenia stawów, chemiczne mediatory zapalenia błony maziowej mogą uwrażliwić te nocyceptory, a ponadfizjologiczne poziomy stresu mogą nie być już wymagane do stymulacji bólu. Takie mediatory zapalne (substancja P, bradykinina, fosfolipaza A2) wykryto w torebce stawu międzykręgowego.
Nocyceptory w krążkach międzykręgowych są zwykle ograniczone do zewnętrznej jednej trzeciej pierścienia, mogą być substratem na dyskogenny ból, gdy rozszerzają się na większy obszar pierścieniowy i wnikają dalej w zdegenerowany krążek wzdłuż układu naczyniowego i worków. Te włókna C i A δ są prawdopodobnie odpowiedzialne za przekazywanie odpowiedzi bólowych. Więzadło podłużne tylne i warstwa zewnętrznego pierścienia fi brozusa krążka międzykręgowego zawierają dużo włókien nocyceptywnych. Włókna nerwowe i zakończenia nerwowe występują również w kości podchrzęstnej stawów zygapofizjalnych. Występują w kanałach erozji rozciągających się od kości podchrzęstnej do chrząstki stawowej.
Badanie przeprowadzone na ludziach (Kiter i in., 2010) wykazało zarówno wolne, jak i otorbione zakończenia nerwowe w więzadle biodrowo-lędźwiowym człowieka. Badania przeprowadzone przez (Hirsch i in., 1963) zasugerowali obecność drobnych włókien nerwowych i złożonych niezakapsułkowanych zakończeń w więzadłach nadkręgowych i wewnątrzrdzeniowych.
- Viscera
Nocyceptory trzewne nie reagują na skaleczenia lub oparzenia, tak jak ich odpowiedniki w obwodowej tkance skórnej. Zamiast tego są aktywowane w odpowiedzi na patologiczną zmianę. Bodźce wywołujące ból w trzewiach, w tym trakcja krezki, zapalenie, rozdęcie wydrążonych narządów o ściankach mięśniowych, takich jak przewód pokarmowy, drogi moczowe, woreczek żółciowy oraz silne skurcze warstw mięśni otaczających takie narządy, podrażnienia chemiczne lub niedokrwienie narządów, takich jak serce. Rozmieszczenie tych włókien jest różne w różnych narządach. Receptory wysokoprogowe unerwiają wyłącznie narządy, z których ból jest jedynym świadomym odczuciem (tj. Moczowód, nerki, płuca, serce), ale jest ich stosunkowo niewiele w narządach, które zapewniają nieszkodliwe i szkodliwe odczucia (np. Okrężnica, żołądek i pęcherz), unerwione głównie przez receptory niskoprogowe. Narządy, takie jak wątroba, płuca, nerki i trzustka, mają niewiele receptorów, ale ból z tych narządów pochodzi głównie z aktywacji receptorów w torebkach tych narządów. Nocyceptywna stymulacja wnętrzności prowadzi do bólu rozproszonego, trudnego do zlokalizowania. Aferentne włókna nocyceptywne we wnętrznościach występują w połączeniu z nerwami współczulnymi i przywspółczulnymi. Większość narządów trzewnych jest unerwiana przez nerw błędny, ale badania nie wykazują jednoznacznie, czy ten nerw jest zdolny do przenoszenia nocyceptywnego aferentnego wkładu. Jednak niektóre badania jasno pokazują, że nerwy nerwowe błędne przekazują informacje o bodźcach mechanicznych o dużym natężeniu do ośrodkowego układu nerwowego. Szereg badań z udziałem ludzi lub zwierząt wykazało, że osoby z uszkodzeniem rdzenia kręgowego mogą zgłaszać ból prawdopodobnie pochodzący z okolicy narządów trzewnych.
- 1,0 1,1 Loeser JD, Treede RD. Protokół z Kioto IASP Basic Pain Terminology. Ból. 2008; 137 (3): 473–7. doi: 10.1016 / j.pain.2008.04.025. PMID 18583048
- Basbaum AI, Jessell T. The Perception of Pain. W: Kandel ER, Schwartz J, Jessell T. redaktorzy. Zasady neuronauki. Nowy Jork: Appleton i Lange; 2000. str. 472-491
- 3,0 3,1 3,2 3,3 3,4 3,5 Meyer RA, Ringkamp M, Campbell JN, Raja SN. Peryferyjne mechanizmy nocycepcji skórnej. W: McMahon SB, Koltzenburg M, red. Wall and Melzack’s Textbook of Pain. Londyn: Elsevier; 2006. s3–34.
- Lloyd DPC. Wzorce neuronowe kontrolujące transmisję odruchów kończyn tylnych po tej samej stronie u kota. J Neurophysiol. 1943; 6: 293–315
- 5,0 5,1 5,2 Schaible HG, Schmidt RF. Wpływ eksperymentalnego zapalenia stawów na właściwości sensoryczne precyzyjnych jednostek doprowadzających stawowych. Journal of Neurophysiology. 1985; 54: 1109–1122
- Häbler HJ, Jänig W, Koltzenburg M.Nowy typ niemielinowego nocyceptora chemoczułego w ostrym zapaleniu pęcherza moczowego. Agenci i akcje. 1988; 25: 219-221
- Tanelian DL. Cholinergiczna aktywacja populacji nerwów doprowadzających rogówkę. Eksperymentalne badania mózgu. 1991; 86: 414-420
- LaMotte RH, Campbell JN. Porównanie odpowiedzi ciepłych i nocyceptywnych aferentów włókna C u małpy z oceną bólu termicznego człowieka. Journal of Neurophysiology. 1978; 41: 509–528
- Treede RD, Meyer RA, Raja SN, Campbell JN. Dowody na dwa różne mechanizmy przewodzenia ciepła w nocyceptywnych pierwotnych aferentach unerwiających skórę małpy. Journal of Physiology. 1995; 483: 747-758
- Schepers RJ, Ringkamp M. Thermoreceptors and thermosensitive aferents. Neuroscience & Biobehavioral Reviews. 2010; 34 (2): 177-184
- Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. Receptor kapsaicyny: aktywowany ciepłem kanał jonowy w szlaku bólu. Nature 1997; 389: 816–824
- Bjur D, Alfredson H, Forsgren S. Wzorzec unerwienia ludzkiego ścięgna Achillesa: badania normalnego i ścięgna ścięgna ze znacznikami unerwienia ogólnego i czuciowego. Cell Tissue Res. 2005; 320: 201–206
- 13,0 13,1 Ashton IK, Ashton BA, Gibson SJ, Polak JM, Jaffray DC, Eisenstein SM. Podstawy morfologiczne bólu pleców: wykazanie włókien nerwowych i neuropeptydów w torebce stawu lędźwiowego, ale nie w więzadle krzyżowym. J Orthop Res. 1992; 10 (1): 72-78
- Kiter E, Karaboyun T, Tufan AC, Acar K. ImmunohistochemicalfckLR Demonstracja wolnych zakończeń nerwowych w więzadle biodrowo-lędźwiowym. Kręgosłup. 2010; 35 (4): E101-4. doi: 10.1097 / BRS.0b013e3181ae561d.
- Hirsch C, Ingelmark BE, Miller M. Anatomiczna podstawa bólu pleców o niskiej częstotliwości. Badania nad obecnością zakończeń nerwów czuciowych infckLRzwiązane, torebkowe i międzykręgowe struktury krążka w kręgosłupie lędźwiowym człowieka. Acta Orthop Scand. 1963; 33: 1–17.
- Moller, Aage (22.04.2014). Ból, jego anatomia, fizjologia i leczenie. Wersja Kindle.
