Nociceptorii pot fi activați de trei tipuri de stimul în țesutul țintă – temperatura (termică), mecanică (de ex. Întindere / tulpină) și chimică (de exemplu, schimbarea pH-ului) ca urmare a procesului inflamator local). Astfel, un stimul nociv poate fi clasificat în unul dintre aceste trei grupuri.
Termenii nocicepțiune și durere nu trebuie folosiți sinonim, deoarece fiecare poate apărea fără celălalt. Durerea care apare din activarea nociceptorilor se numește durere nociceptivă. Durerea nociceptivă poate fi clasificată în funcție de țesutul în care s-a produs activarea nociceptorului: somatic superficial (de ex. Piele), somatic profund (de ex. Ligamente / tendoane / oase / mușchi) sau visceral (organe interne).
Calea Nociception
Nu fiecare nociceptor răspunde la fiecare tip a stimulilor nocivi. Lipsa aparentă a unui răspuns la un stimul nociv poate rezulta din cauza receptorilor diferiți localizați pe membrana terminalului terminal (capătul nervului liber) sau intensitatea stimulului este insuficientă. De obicei, pragul de stimulare al unui nociceptor este sub intensitatea deteriorării țesuturilor. Nociceptorii au proprietăți eterogene, răspunzând la mai multe modalități de stimulare (polimodale). Cu toate acestea, aplicarea stimulului nociv al unei modalități poate modifica proprietățile de răspuns ale nociceptorului la alte modalități. De asemenea, aplicarea unui anumit stimul pentru o anumită perioadă de timp poate induce modificări pe termen lung în proprietățile de răspuns ale nociceptorului. Leziunea și inflamația scad pragul și măresc amploarea răspunsului pentru un stimul dat, fenomen cunoscut sub numele de sensibilizare periferică. Un interes deosebit îl reprezintă aferențele nemelinizate sensibile la căldură, dar insensibile din punct de vedere mecanic, care dezvoltă sensibilitate mecanică numai în condițiile de rănire.
Nociceptorii au aspectul morfologic al terminațiilor nervoase libere. Termenul „terminație nervoasă liberă” indică faptul că în microscopul cu lumină nu se poate recunoaște nicio structură receptivă (corpusculară) .În prezent, nu există diferențe ultrastructurale clare între terminațiile nervoase libere non-nociceptive (de exemplu, mecanoreceptori sensibili și termoreceptori) și nociceptivi . Funcțional, diferite terminații nervoase libere
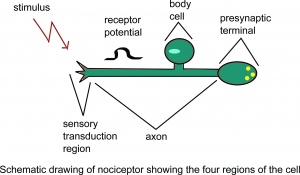
Desen schematic al nociceptorului care arată patru regiuni ale celulei.
se presupune că posedă diferite seturi de molecule de receptori în membrana lor axonală. Moleculele receptor care sunt deosebit de importante pentru funcția nociceptorilor musculari sunt canale ionice care detectează acidul. (ASIC) care se deschid la un pH scăzut al țesuturilor, receptorii P2X3 care sunt activați prin legarea adenozin trifosfatului (ATP) și receptorului tranzitoriu potențial subtipul receptorului 1 (TRPV1) care este sensibil la temperaturi ridicate, substanțe chimice de capsaicină și pH scăzut. substanța neuropeptidică P are s-a raportat că este prezent predominant în fibrele aferente nociceptive. În timp ce există numeroși neurotransmițători în sistemul nervos, cei mai frecvenți trei participanți la transmiterea nociceptivă sunt peptidele, purinele și aminoacizii excitatori (EAA). EAA, în special glutamatul, produc răspunsul inițial excitator pe neuronul postsinaptic, de ordinul doi, urmat de eliberarea peptidelor, inclusiv a substanței P, provocând o depolarizare mai prelungită și o transmisie nociceptivă susținută
Nociceptorii sunt prezenți în multe țesuturi ale corpului, dar nu au fost găsite în cartilajul articular, pleura viscerală, parenchimul pulmonar, pericardul, creierul și țesutul cordonului.
Tipuri de nociceptori
Mai multe clase de au fost descriși nociceptorii. Unii nociceptori răspund la frig nociv, căldură nocivă și stimuli mecanici cu prag ridicat, precum și la o varietate de mediatori chimici. Nociceptorii, deși polimodali, pot fi împărțiți în continuare în două clase principale pe baza răspunsului la stimulii mecanici, ducând la o distincție între aferenții sensibili mecanic (MSA) și aferenți insensibili mecanic (MIA) definiți ca aferenți care au praguri mecanice foarte mari sau nu răspund la stimulii mecanici.
Nociceptorii pot fi clasificați după viteza de conducere a axonilor sau a diametrului fibrelor lor, aceasta este grupa III și IV, respectiv A ord și respectiv C.
Aferențe mielinizate de diametru mediu de tip Aδ care mediază durerea acută, bine localizată, de tip intepatura ascuțită, cunoscută sub numele de aferentă grupului III. Fibrele aferente Aδ au un diametru mediu al fibrelor de 2-5 mm și o viteză conductivă de 5-30 m / s. A nociceptorii pot fi împărțiți în continuare în două tipuri (se pare că există aproximativ 50% din fiecare tip)
- Tipul I Aδ sunt aferente sensibile mecanic (MSA) care răspund cu o descărcare lentă care se adaptează presiunea punctuală.De asemenea, răspund la căldură și stimulii chimici și au praguri relativ ridicate de căldură (> 50C).
- Nociceptorii de tip II Aδ au prag de căldură mai scăzut decât unitățile de tip I, dar au praguri mecanice foarte ridicate (numite aferente insensibile mecanic – MIA). Activitatea acestui aferent mediază cu siguranță „primul” răspuns dureros acut la căldură nocivă. Au fost raportate în articulația genunchiului, viscerelor și corneei.
Fibre aferente nemelinizate de tip C care transmit plictiseala slab localizată, arzătoare, așa-numita „a doua” durere sau lentă este cunoscută sub numele de grupul IV. Diametrul mediu al fibrei este sub 2 mm și viteza conductoare este de 2 m / s sau mai mică. Fibrele C nemielinate sunt, de asemenea, eterogene. Aferenții fibrei C pot fi împărțiți în două clase pe baza răspunsului lor la stimulii mecanici. La fel ca fibrele aferente Aδ mielinizate, majoritatea fibrelor C sunt polimodale, adică includ o populație atât sensibilă mecanic, cât și sensibilă la căldură (CMH). Răspunsul CMH este, de asemenea, puternic influențat de istoricul stimulilor. Se observă atât oboseala, cât și sensibilizarea. O scădere a răspunsului la căldură se observă și în urma stimulilor mecanici aplicați câmpului receptiv sau a stimulilor electrici aplicați trunchiului nervos. Acest lucru sugerează că oboseala ca răspuns la o anumită modalitate de stimul poate fi indusă prin stimulare heterologă, adică prin excitație cu un stimul de o altă modalitate. Acestea sunt tipul predominant de nociceptori din fibra C în pielea mamiferelor. Fibrele C insensibile mecanic (C-MIA) fie nu răspund la stimulii mecanici, fie au un prag mecanic foarte ridicat. Aceste aferente răspund la căldură și la diferiți stimuli chimici nocivi (de exemplu, capsaicină, histamină) și sunt adesea considerați a fi chemoreceptori.
În rezumat la cele de mai sus, senzația de durere imediată, bine localizată, zgârcită este mediat de fibre nervoase mielinizate cu diametru mic, tip Aδ. Fibrele C mediază tipul de durere anatomic slab localizat, are un caracter dureros și arzător, vine mai târziu de prima senzație inițială și este dificil de estimat puterea acestuia.
Canalele TRP
Nociceptorii răspund la anumite intervale de temperatură și stimul mecanic.
Capătul periferic al axonului conține proteine încapsulate numite proteine de transducție (TRP), care pot fi activate de un stimul specific. Superfamilia multigenă a potențialului receptorului tranzitoriu (TRP) codifică proteinele integrale ale membranei care funcționează ca canale ionice. Familia de canale TRP este de interes, deoarece mai mulți membri au fost implicați în transducția semnalului nociceptor.
Stimuli nocivi de frig și căldură nocivi sunt detectați de nociceptorii din fibre Aδ și C. Familia de canale TRP oferă un grup de molecule echipate pentru a detecta modificările termice. Gama completă de temperaturi, de la frigul nociv la căldura nocivă, pare a fi transdusă de activitatea din aceste canale ionice. TRPM8 și TRPV3 / 4 codifică rece și cald, respectiv, TRPA1 traduce frigul nociv și TRPV1 / 2 simte căldura nocivă. Unele dintre canalele TRP termosensibile răspund și stimulilor chimici și mecanici.
De exemplu, TRPV1 este esențial pentru transducerea nociceptivului prin efecte inflamatorii și hipotermice ale compușilor vaniloizi și contribuie la nocicepția termică acută și la hiperalgezia termică după leziuni tisulare. Curentul TRPV1 este potențat de bradichinină și factorul de creștere a nervilor prin mai multe mecanisme posibile și este, de asemenea, activat de protoni și capsaicină, compusul „fierbinte” din ardeii iute. Spre deosebire de hiperalgezia care urmează stimulilor nocivi intensi, expunerea prelungită la capsaicină poate duce la desensibilizarea ulterioară. indică faptul că mecanismele de transducție multiple și încă necunoscute sunt angajate de stimuli termici.
Mediatori chimici
Leziunea are ca rezultat eliberarea locală a numeroaselor substanțe chimice din celulele non-neuronale (de exemplu, fibroblaste, mastocite, neutrofile, monocite și trombocite), precum și din terminalele senzoriale ale fibrelor aferente primare care mediază sau facilitează procesul inflamator. Mediatorii inflamatori includ prostaglandine, leucotriene, bradikinină, serotonină, histamină, SP, tromboxani, factor de activare a trombocitelor, purine precum adenozină și ATP, protoni și radicali liberi. Citokinele, cum ar fi interleukinele și factorul de necroză tumorală, și neurotrofinele, în special NGF, sunt, de asemenea, generate în timpul inflamației.Este de remarcat faptul că majoritatea acestor substanțe chimice (în principal substanțe precum bradikinina și prostaglandina E2) sunt considerate, în general, că nu activează direct nociceptorii, ci îmbunătățesc mai degrabă senzația de durere ca răspuns la stimuli naturali și alte substanțe chimice endogene, prin creșterea frecvenței acțiunii. declanșare potențială.
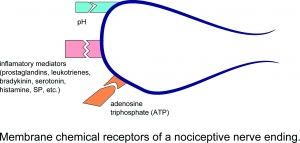
Receptorii chimici cu membrană ai unei terminații nervoase nociceptive.
Activarea nociceptorilor nu numai că transmite mesaje aferente către cornul dorsal al măduvei spinării, ci și inițiază procesul de inflamație neurogenă. Inflamația neurogenă determină eliberarea de neurotransmițători, în special substanța P și peptida legată de gena calcitoninei (CGRP), ceea ce duce la vasodilatație severă, precum și la scurgerea plasmatică a proteinelor și a fluidelor din venulele post-capilare.
Două substanțe chimice prezintă un interes deosebit:
- Adenozin trifosfat (ATP)
ATP este molecula purtătoare de energie în toate celulele corpului. Este eliberat din toate țesuturile în timpul traumei și altor modificări patologice care sunt asociate cu moartea celulară. Din acest motiv, ATP a fost considerat o substanță semnal generală pentru traumatismele și durerea țesuturilor. În studiile microneurografice la om, injectarea de ATP a activat 60% din fibrele C-nociceptive mecanic-receptive și insensibile la mecanic fără a sensibiliza aceste fibre la stimuli mecanici sau de căldură. ATP activează receptorii purinergici P2X3 în nociceptori provocând o descărcare. ATP este deosebit de important pentru durerile musculare, deoarece este prezent în celulele musculare în concentrație mare.
- Modificarea protonilor în pH-ul țesutului
Canalele ionice cu sensibilitate la acid (ASIC) constituie o familie de molecule receptor care sunt sensibile la o scădere a pH-ului și deschise la diferite valori de pH. Proteinele din canal reacționează deja la modificări prea mici ale pH-ului. Această familie de receptori (de exemplu ASIC1 și ASIC3) este deosebit de importantă pentru durerea musculară, deoarece aproape toate modificările patologice ale mușchilor sunt însoțite de o scădere a pH-ului țesutului, de exemplu, exerciții fizice epuizante, ischemie și inflamație.
Localizarea Nociceptorilor
Corpurile celulare ale nociceptorilor sunt situate în ganglionii rădăcinii dorsale (DRG) pentru periferie și în ganglionul trigemen pentru față. Axonii lor se extind în sistemul nervos periferic și se termină în ramuri creând câmpuri receptive.
- <
- Pielea
Terminațiile nervoase libere care se termină în piele sunt mașinile pentru semnalizarea modificărilor mecanice, termice și chimice locale. Marea majoritate a terminațiilor nervoase libere din piele sunt numite nociceptori polimodali deoarece conțin receptori multipli și astfel răspund la diferite combinații ale stimulului menționat mai sus. Unitățile de mecanoreceptori cu prag înalt Aδ de tip I sunt distribuite dens în pielea păroasă și glabră.
- Muschii
Moleculele receptorilor care sunt deosebit de importante pentru funcția nociceptorilor musculari sunt canale ionice sensibile la acid (ASIC) care se deschid la un pH scăzut al țesuturilor, receptori P2X3 care sunt activați prin legarea adenozin trifosfatului (ATP) și receptorului tranzitoriu receptor subtip 1 (TRPV1) care este sensibil la temperaturi și pH scăzut.
În mușchiul scheletic, terminațiile nervoase libere par a fi distribuite destul de uniform. Nu s-a găsit nicio diferență între porțiunile proximale și distale ale mușchiului gastrocnemius-soleus de șobolan. Cu toate acestea, în același studiu, sa constatat că densitatea fibrelor nervoase din peritendineul tendonului calcaneal al șobolanului este de câteva ori mai mare decât cea din mușchiul GS. În schimb, fasciculele de fibre de colagen ale țesutului tendinos propriu-zis erau aproape lipsite de terminații nervoase libere.
- Articulația
- Viscera
- 1.0 1.1 Loeser JD, Treede RD. Protocolul de la Kyoto al terminologiei de durere de bază IASP. Durere. 2008; 137 (3): 473-7. doi: 10.1016 / j.pain.2008.04.025. PMID 18583048
- Basbaum AI, Jessell T. Percepția durerii. În: Kandel ER, Schwartz J, Jessell T. editori. Principiile Neuroștiinței. New York: Appleton și Lange; 2000. p472-491
- 3.0 3.1 3.2 3.3 3.4 3.5 Meyer RA, Ringkamp M, Campbell JN, Raja SN. Mecanisme periferice ale nocicepției cutanate. În: McMahon SB, Koltzenburg M, editori. Wall and Melzack’s Textbook of Pain. Londra: Elsevier; 2006. p3–34.
- DPC Lloyd. Modele neuronice care controlează transmiterea reflexelor ipsilaterale ale membrelor posterioare la pisică. J Neurofiziol. 1943; 6: 293-315
- 5.0 5.1 5.2 Schaible HG, Schmidt RF. Efectele unei artrite experimentale asupra proprietăților senzoriale ale unităților aferente articulare fine. Jurnalul de neurofiziologie. 1985; 54: 1109-1122
- Häbler HJ, Jänig W, Koltzenburg M.Un tip nou de nociceptor chemosensibil nemielinizat în vezica urinară inflamată acut. Agenți și acțiuni. 1988; 25: 219-221
- Tanelian DL. Activarea colinergică a unei populații de nervi aferenți corneeni. Cercetări experimentale pe creier. 1991; 86: 414-420
- LaMotte RH, Campbell JN. Comparația răspunsurilor aferente ale fibrelor C calde și nociceptive la maimuță cu judecățile umane privind durerea termică. Jurnalul de neurofiziologie. 1978; 41: 509-528
- Treede RD, Meyer RA, Raja SN, Campbell JN. Dovezi pentru două mecanisme diferite de transducție a căldurii în aferențele primare nociceptive care inervează pielea maimuței. Jurnalul de fiziologie. 1995; 483: 747-758
- Schepers RJ, Ringkamp M. Termoreceptori și aferenți termosensibili. Neuroștiințe & Recenzii de comportament biologic. 2010; 34 (2): 177-184
- Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. Receptorul capsaicinei: un canal ionic activat termic în calea durerii. Natura 1997; 389: 816–824
- Bjur D, Alfredson H, Forsgren S. Modelul de inervație al tendonului Ahile uman: studii ale tendonului normal și tendinoz cu markeri pentru inervația generală și senzorială. Rez. Țesutului celular 2005; 320: 201-206
- 13.0 13.1 Ashton IK, Ashton BA, Gibson SJ, Polak JM, Jaffray DC, Eisenstein SM. Baza morfologică a durerilor de spate: demonstrarea fibrelor nervoase și a neuropeptidelor în capsula articulației fațetei lombare, dar nu și în ligamentum flavum. J Orthop Res. 1992; 10 (1): 72-78
- Kiter E, Karaboyun T, Tufan AC, Acar K. ImunohistochimicfckLRDemonstrarea terminațiilor nervoase libere în ligamentul iliolombar. Coloana vertebrală. 2010; 35 (4): E101-4. doi: 10.1097 / BRS.0b013e3181ae561d.
- Hirsch C, Ingelmark BE, Miller M. Baza anatomică a durerii lowfckLRback. Studii privind prezența terminațiilor nervoase senzoriale infckL Structuri de discuri rigide, capsulare și intervertebrale în coloana vertebrală lombară umană. Acta Orthop Scand. 1963; 33: 1–17.
- Moller, Aage (22.04.2014). Durerea, anatomia, fiziologia și tratamentul ei. Editia kindle.
- Tenduri
Inervația tendoanelor lui Ahile umane este asigurat de nervii din mușchii din jur și de micii fasciculi din nervii cutanati, dar acest lucru implică toate terminațiile nervoase. Terminațiile nervoase libere sunt reprezentate în interiorul tendoanelor, dar în principal în țesutul peritendinos, sunt receptori ai durerii. Numărul și localizarea tuturor fibrelor nervoase și a terminațiilor nervoase variază în funcție de funcția tendonului, fiind mai reprezentate în tendoanele mai mici implicate în mișcări fine.
Nociceptorii din articulații sunt localizați în capsula articulară, ligamente și tendoane proximale, os, periost, tampon articular de grăsime și în jurul vaselor de sânge, dar nu în cartilajul articular. Aferențele nociceptive cu prag ridicat se termină în principal în sinoviu și periost și răspund în mod normal doar la mișcarea articulației dincolo de limitele de lucru. După deteriorarea articulațiilor, doi factori se combină pentru a modifica sensibilitatea mecanică a nociceptorilor articulari.În primul rând, modificările fizice (revărsarea articulațiilor și edemul țesutului) modifică forțele de odihnă și induse de mișcare exercitate asupra țesuturilor articulare și, în al doilea rând, mediatorii inflamatorii eliberați în țesutul deteriorat sensibilizează aferențele nociceptive articulare prin legarea la receptorii de pe terminațiile nervoase. Mulți nociceptori ai articulației răspund la mișcări inofensive, dar sunt din ce în ce mai activate atunci când mișcările depășesc domeniul de lucru fiziologic, în timp ce alți nociceptori sunt activi exclusiv în timpul mișcărilor nocive. Al treilea grup de așa-numiți nociceptori tăcuți sunt în mod normal inactivi și răspund doar în circumstanțe patologice, cum ar fi inflamația.
S-a demonstrat că capsula articulației fațetei lombare este bogat inervată de nociceptori și fibre proprioceptive. Într-o stare normală, nociceptorii, cum ar fi cei observați în capsula articulației fațetelor, au un prag ridicat și nu ar fi de așteptat să se descarce decât dacă sarcinile sunt suprafiziologice. Cu toate acestea, în prezența inflamației articulare patologice, mediatori chimici sinovitici pot sensibiliza acești nociceptori, iar nivelurile de stres suprafiziologic nu mai pot fi necesare pentru a stimula durerea. Astfel de mediatori inflamatori (substanța P, bradikinina, fosfolipaza A2) au fost detectați în capsula articulației fațetelor.
Nociceptorii din discurile intervertebrale sunt în mod normal limitați la treimea exterioară a inelului, ar putea fi substratul pentru durerea discogenică atunci când sunt extinse peste zona inelară mai mare și pătrund în continuare în discul degenerat de-a lungul vasculaturii și a fisurilor. Acei biberoși C și A sunt probabil responsabili de transmiterea răspunsurilor la durere. Ligamentul longitudinal posterior și straturile exterioare ale discului intervertebral conțin numeroase fibre nociceptive. Fibrele nervoase și terminațiile nervoase apar și în osul subcondral al articulațiilor zigapofiziale. Acestea apar în canalele de eroziune care se extind de la osul subcondral la cartilajul articular.
Un studiu realizat de om (Kiter și colab., 2010) a arătat atât terminațiile nervoase libere, cât și cele încapsulate în ligamentul iliolombar uman. Studie de (Hirsch și colab., 1963) a sugerat prezența unor fibre nervoase fine și a unor terminații complexe necapsulate în ligamentele supraspinoase și intraspinoase.
- <
Nociceptorii viscerali nu răspund la leziuni de tăiere sau arsuri, ca și omologii lor din țesutul cutanat periferic. În schimb, acestea sunt activate ca răspuns la schimbările patologice. Dureri care produc stimuli în viscere, inclusiv tracțiune în mezenter, inflamație, distensie a organelor cu pereți musculari, cum ar fi tractul gastro-intestinal, urinar, vezica biliară și contracții puternice ale straturilor musculare care înconjoară astfel de organe goale, substanțe iritante chimice sau ischemie în organe precum inima. Distribuția acestor fibre variază între organe. Receptorii cu prag înalt inervează exclusiv organele din care durerea este singura senzație conștientă (adică ureterul, rinichii, plămânii, inima), dar sunt relativ puțini în organele care oferă senzații inofensive și nocive (de exemplu, colon, stomac și vezică), inervat mai ales de receptori cu prag scăzut. Organele, cum ar fi ficatul, plămânii, rinichii și pancreasul, au puțini receptori, dar durerea acestor organe provine în principal din activarea receptorilor din capsulele acestor organe. Stimularea nociceptivă a viscerelor duce la dureri difuze greu de localizat. Fibrele nociceptive aferente din viscere se găsesc în asociere cu nervii simpatici și parasimpatici. Majoritatea organelor viscerale sunt inervate de nervul vagal, dar studiile nu arată clar dacă acest nerv este sau nu capabil să poarte intrări aferente nociceptive. Cu toate acestea, unele studii demonstrează în mod clar că aferențele vagale transmit informații despre stimulii mecanici de intensitate ridicată către sistemul nervos central. O serie de studii care au implicat oameni sau animale au arătat că subiecții cu leziuni ale coloanei vertebrale sunt capabili să raporteze dureri care provin probabil din zona organelor viscerale.
