Nossiseptorit voidaan aktivoida kolmen tyyppisillä ärsykkeillä kohdekudoksessa – lämpötila (terminen), mekaaninen (esim. Venytys / kanta) ja kemiallinen (esim. PH-muutos) paikallisen tulehdusprosessin seurauksena). Siksi haitallinen ärsyke voidaan luokitella yhteen näistä kolmesta ryhmästä.
Termejä nociception ja kipu ei tule käyttää synonyymeinä, koska kumpikin voi esiintyä ilman toisiaan. Nociceptorien aktivoitumisesta johtuvaa kipua kutsutaan nosiceptive-kipuksi. Nosiseptiivinen kipu voidaan luokitella kudoksen mukaan, jossa nociceptorin aktivaatio tapahtui: pinnallinen somaattinen (esim. Iho), syvä somaattinen (esim. Nivelsiteet / jänteet / luut / lihakset) tai sisäelimet (sisäelimet).
Nociception-reitti
Kaikki nociceptorit eivät vastaa kullekin tyypille haitallisista ärsykkeistä. Ilmeinen vastauksen puute haitalliselle ärsykkeelle voi johtua loppupään kalvoon sijoitetuista erilaisista reseptoreista (vapaa hermopää) tai ärsykkeen voimakkuus on riittämätön. Yleensä notoseptorin stimulaatiokynnys on kudosta vahingoittavan intensiteetin alapuolella. Nossiseptoreilla on heterogeenisiä ominaisuuksia, jotka reagoivat useisiin ärsykemoodeihin (polymodaaliset). Yhden modaliteetin haitallisen ärsykkeen käyttö voi kuitenkin muuttaa nokkoseptorin vasteominaisuuksia muihin modaliteetteihin. Lisäksi tietyn ärsykkeen käyttö tietyn ajan voi aiheuttaa pitkäaikaisia muutoksia notoseptorin vasteominaisuuksissa. Loukkaantuminen ja vahvistuminen pienentävät kynnystä ja lisäävät tietyn ärsykkeen vastetta, ilmiö tunnetaan perifeerisenä herkistymisenä. Erityisen mielenkiintoista on lämpöherkät, mutta mekaanisesti epäherkät myeliinittömät afferentit, jotka kehittävät mekaanista herkkyyttä vain loukkaantumisen yhteydessä.
Nociceptoreilla on vapaiden hermopäätteiden morfologinen ulkonäkö. Termi ”vapaa hermopää” osoittaa, että valomikroskoopissa ei voida tunnistaa mitään (korpuskulaarista) vastaanottavaa rakennetta. Tällä hetkellä ei ole selkeitä ultrakonstruktionaalisia eroja ei-notiseptiivisten vapaiden hermopäätteiden (esim. Herkkien mekanoreseptorien ja termoreseptorien) ja nosiseptiivisten välillä. Toiminnallisesti erilaiset vapaat hermopäätteet
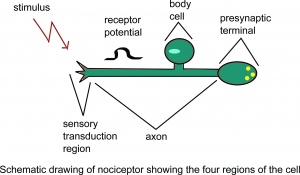
kaaviokuva nociceptorista, jossa näkyy neljä solun aluetta.
oletetaan, että niiden aksonaalisessa kalvossa on erilaisia reseptorimolekyylisarjoja. Reseptorimolekyylit, jotka ovat erityisen tärkeitä lihassoseptorien toiminnan kannalta, ovat happoa tunnistavia ionikanavia (ASIC: t), jotka avautuvat matalassa kudoksen pH: ssa, P2X3-reseptorit, jotka aktivoituvat sitoutumalla adenosiinitrifosfaattia (ATP), ja ohimenevän reseptorin potentiaalisen reseptorin alatyypin 1 (TRPV1), joka on herkkä korkeille lämpötiloille, kapsaisiinikemikaalille ja matalalle pH: lle. neuropeptidiaineella P on on raportoitu esiintyvän pääasiassa notoseptiivisissä afferenteissa kuiduissa. Vaikka hermojärjestelmässä on lukuisia välittäjäaineita, kolme yleisimmin notoseptiiviseen siirtoon osallistuvat peptidejä, puriineja ja virittäviä aminohappoja (EAA). EAA, erityisesti glutamaatti, tuottaa ensimmäisen viritysvasteen postsynaptisessa, toisen asteen hermosoluissa, minkä jälkeen vapautuu peptidejä, mukaan lukien aine P, aiheuttaen pidempää depolarisoitumista ja pitkittynyttä nenäseptiivistä siirtymistä
Nociceptoreita on läsnä monissa kehokudoksissa, mutta niitä ei ole löydetty nivelrustosta, sisäelinten pleurasta, keuhkoparenhymasta, sydänpussista, aivoista ja johtosolukudoksesta.
Nociceptorityypit
Useita luokkia notoseptoreita on kuvattu. Jotkut notiseptorit reagoivat haitalliseen kylmään, haitalliseen lämpöön ja korkean kynnyksen mekaanisiin ärsykkeisiin sekä erilaisiin kemiallisiin välittäjiin. Nociceptorit, vaikka ne ovatkin polymodaalisia, voidaan edelleen jakaa kahteen pääluokkaan vasteen perusteella mekaanisiin ärsykkeisiin, mikä johtaa eroon mekaanisesti herkkien afferenttien (MSA) ja mekaanisesti epäherkkien afferenttien (MIA) välillä, jotka määritellään afferenteiksi, joilla on erittäin korkeat mekaaniset kynnysarvot tai eivät reagoi mekaanisiin ärsykkeisiin.
Nossiseptorit voidaan luokitella niiden aksonien tai kuitujen halkaisijan johtumisnopeuden perusteella, tämä on ryhmä III ja IV eli Aδ ja C vastaavasti.
Tyypin Aδ keskihalkaisijat myelinoidut afferentit, jotka välittävät akuuttia, hyvin lokalisoitua, terävää pistävää tyyppiä olevaa kipua, joka tunnetaan ryhmän III afferenttina. Aδ-afferenttien kuitujen keskimääräinen kuidun halkaisija on 2-5 mm ja johtavuusnopeus 5-30 m / s. Aδ-nossiseptorit voidaan edelleen jakaa kahteen tyyppiin (näyttää olevan noin 50% kustakin tyypistä).
- Tyyppi I Aδ ovat mekaanisesti herkkiä afferentteja (MSA), jotka reagoivat hitaasti sopeutuvalla vastuuvapaudella voimakkaaseen välitä paine.Ne reagoivat myös lämpö- ja kemiallisiin ärsykkeisiin ja niillä on suhteellisen korkeat lämpökynnykset (> 50C).
- Tyypin II Aδ -posiseptoreilla on alhaisempi lämpökynnys kuin tyypin I yksiköillä, mutta niillä on erittäin korkeat mekaaniset kynnysarvot (kutsutaan mekaanisesti epäherkiksi afferenteiksi – MIA). Tämän afferentin aktiivisuus välittää melkein varmasti ”ensimmäisen” akuutin kipuvasteen haitalliselle lämmölle. Niitä on raportoitu polvinivelessä, sisäelimissä ja sarveiskalvossa.
Tyypin C mymyelinittymättömät afferenttikuidut, jotka välittävät huonosti lokalisoitu tylsä, palava, niin kutsuttu ”toinen” tai hidas kipu tunnetaan ryhmänä IV. Keskimääräinen kuidun halkaisija on alle 2 mm ja johtavuusnopeus on 2 m / s tai vähemmän. Myös myymeloimattomat C-kuidut ovat heterogeenisiä. C-kuidun afferentit voidaan jakaa kahteen luokkaan niiden reaktion perusteella mekaanisiin ärsykkeisiin. Kuten myelinisoidut Aδ-afferentit kuidut, suurin osa C-kuiduista on polymodaalisia, ts. Ne sisältävät populaation, joka on sekä mekaanisesti että lämpöherkkä (CMH). CMH-reaktioon vaikuttaa voimakkaasti myös ärsykehistoria. Sekä väsymystä että herkistymistä havaitaan. Lämpövasteen väheneminen havaitaan myös vastaanottavaan kenttään kohdistettujen mekaanisten ärsykkeiden tai hermotilaan kohdistettujen sähköisten ärsykkeiden jälkeen. Tämä viittaa siihen, että väsymys vastauksena tiettyyn ärsykemoodaliteettiin voidaan indusoida heterologisella stimulaatiolla, ts. Virittämällä erilaisten modaalien ärsykkeellä. Nämä ovat hallitsevin tyyppi C-kuidun nociceptoreja nisäkkään ihossa. Mekaanisesti epäherkät C-kuidut (C-MIA) eivät joko reagoi mekaanisiin ärsykkeisiin tai niillä on erittäin korkea mekaaninen kynnys. Nämä afferentit reagoivat lämpöön ja erilaisiin haitallisiin kemiallisiin ärsykkeisiin (esim. Kapsaisiini, histamiini), ja niitä pidetään usein kemoreseptoreina.
Yhteenvetona yllä olevasta on välitön, hyvin lokalisoitu, niukka kivun tunne. välittyvät pienen halkaisijan omaavilla myelinisoiduilla hermokuiduilla, tyyppi Aδ. C-kuidut välittävät huonosti lokalisoitua anatomista kiputyyppiä, sillä on kipeä ja polttava luonne, se tulee myöhemmin kuin ensimmäinen tunne ja sen voimakkuutta on vaikea arvioida.
TRP-kanavat
Soseptorit reagoivat tiettyyn lämpötila-alueeseen ja mekaaniseen ärsykkeeseen.
Aksonin perifeerinen pää sisältää kapseloituja proteiineja, joita kutsutaan transduktioproteiineiksi (TRP) ja jotka voidaan aktivoida tietyllä ärsykkeellä. TRP-multigeenien superperhe koodaa kiinteitä kalvoproteiineja, jotka toimivat ionikanavina. TRP-kanavaperhe on kiinnostava, koska useita jäseniä on ollut mukana notoseptorisignaalin siirrossa.
Haitalliset kylmät ja haitalliset lämpöärsykkeet havaitaan Aδ- ja C-kuitunosiseptoreilla. TRP-kanavaperhe tarjoaa molekyyliryhmän, joka on varustettu lämpömuutosten havaitsemiseen. Näiden ionikanavien aktiivisuus näyttää vaikuttavan täydelliseen lämpötila-alueeseen haitallisesta kylmästä haitalliseen lämpöön. TRPM8 ja TRPV3 / 4 koodaavat vastaavasti viileää ja lämpimää, TRPA1 tuottaa haitallista kylmää ja TRPV1 / 2 aistia haitallista lämpöä. Jotkut lämpöherkistä TRP-kanavista reagoivat myös kemiallisiin ja mekaanisiin ärsykkeisiin.
Esimerkiksi, TRPV1 on välttämätön, jotta notosotsiumi saadaan siirtymään vanilloidiyhdisteiden tulehduksellisilla ja hypotermisillä vaikutuksilla. TRPV1-virtaa voimistaa bradykiniini ja hermokasvutekijä useiden mahdollisten mekanismien kautta, ja sen aktivoivat myös protonit ja kapsaisiini, chilipippurien ’kuuma’ yhdiste. Toisin kuin voimakkaiden haitallisten ärsykkeiden aiheuttama hyperalgesia, pitkäaikainen altistuminen kapsaisiinille voi johtaa myöhempään herkistymiseen.
Vaikka lämpöherkkien TRP-kanavien löytäminen on lisännyt huomattavasti ymmärrystämme lämpöstimulaatioiden transduktiomekanismeista, löydökset eläimistä, joilla on selektiivisiä geeninpoistoja osoittavat, että termiset ärsykkeet vaikuttavat moniin ja vielä tuntemattomiin transduktiomekanismeihin.
Kemialliset välittäjät
Vahinko johtaa lukuisten kemikaalien paikalliseen vapautumiseen ei-hermosoluista (esim. fibroblastit, syöttösolut, neutrofiilit, monosyytit ja verihiutaleet) sekä primaaristen afferenttikuitujen aistipäätteistä jotka välittävät tai helpottavat tulehdusprosessia. Tulehduksellisia välittäjiä ovat prostaglandiinit, leukotrieenit, bradykiniini, serotoniini, histamiini, SP, tromboksaanit, verihiutaleita aktivoiva tekijä, puriinit, kuten adenosiini ja ATP, protonit ja vapaat radikaalit. Sytokiinit, kuten interleukiinit ja tuumorinekroositekijä, sekä neurotrofiinit, erityisesti NGF, syntyvät myös tulehduksen aikana.On syytä huomata, että suurimman osan näistä kemikaaleista (pääasiassa aineista, kuten bradykiniini ja prostaglandiini E2) ei yleensä oteta aktivoitavan notoseptoreita, vaan ne pikemminkin lisäävät kivun tuntemusta vasteena luonnollisille ärsykkeille ja muille endogeenisille kemikaaleille lisäämällä vaikutusten tiheyttä potentiaalinen laukaus.
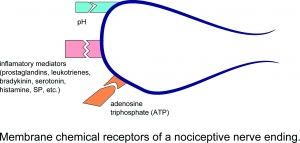
nenoseptiivisen hermopään kalvokemialliset reseptorit.
Nociceptorien aktivointi ei vain välitä afferentteja viestejä selkäytimen selkäpuolelle, vaan myös käynnistää neurogeenisen tulehduksen. Neurogeeninen tulehdus aiheuttaa hermovälittäjäaineiden, erityisesti aineen P ja kalsitoniinigeeniin liittyvän peptidin (CGRP), vapautumisen, mikä johtaa vakavaan verisuonten laajenemiseen sekä proteiinien ja nesteen vuotamiseen plasmasta kapillaarien jälkeisistä laskimosta.
Kaksi kemikaalia kiinnostaa erityisesti:
- Adenosiinitrifosfaatti (ATP)
ATP on energiaa kuljettava molekyyli kaikissa kehon soluissa. Se vapautuu kaikista kudoksista trauman ja muiden solukuolemaan liittyvien patologisten muutosten aikana. Tästä syystä ATP: tä on pidetty yleisenä signaaliaineena kudostraumalle ja -kipulle. Ihmisen mikroneurografisissa tutkimuksissa ATP-injektio aktivoi 60% mekanoreaktioista ja mekaaniherkistä C-nosiseptiivisistä kuiduista herkistämättä näitä kuituja mekaanisille tai lämpöärsykkeille. ATP aktivoi purinergiset P2X3-reseptorit notoseptoreissa aiheuttaen purkautumisen. ATP on erityisen tärkeä lihaskipujen kannalta, koska sitä esiintyy lihassoluissa suurina pitoisuuksina.
- Protonien muutokset kudoksen pH: ssa
Happoa tunnistavat ionikanavat (ASIC) muodostavat reseptorimolekyylien perheen, jotka ovat herkkiä pH-arvon laskulle ja ovat avoimia erilaisilla pH-arvoilla. Kanavaproteiinit reagoivat jo liian pieniin pH-muutoksiin. Tämä reseptoriperhe (esimerkiksi ASIC1 ja ASIC3) on erityisen tärkeä lihaskivun kannalta, koska melkein kaikkiin lihaksen patologisiin muutoksiin liittyy kudoksen pH: n lasku, esim. Uuvuttava liikunta, iskemia ja vahvistuminen.
Nociceptorien sijainti
Nociceptorien solurungot sijaitsevat perifeerisen selkäjuuriganglionissa (DRG) ja kasvojen kolmoishermosanglionissa. Niiden aksonit ulottuvat ääreishermostoon ja päättyvät haaroihin, jotka luovat vastaanottokenttiä.
- Nahka
Ihoon päättyvät vapaat hermopäätteet ovat kone, joka ilmoittaa paikallisista mekaanisista, termisistä ja kemiallisista muutoksista. Suurinta osaa ihon vapaista hermopäätteistä kutsutaan polymodaalisiksi nociceptoreiksi, koska ne sisältävät useita reseptoreita ja reagoivat siten edellä mainitun ärsykkeen erilaisiin yhdistelmiin. Tyypin I Aδ korkean kynnyksen mekanoreseptoriyksiköt jakautuvat tiheästi karvaiseen ja kaljuun ihoon.
- Lihakset
Reseptorimolekyylit, jotka ovat erityisen tärkeitä lihassoseptorien toiminta on happoa tunnistavia ionikanavia (ASIC), jotka avautuvat matalassa kudoksen pH: ssa, P2X3-reseptoreita, jotka aktivoituvat sitoutumalla adenosiinitrifosfaattia (ATP), ja ohimenevän reseptorin potentiaalisen reseptorin alatyyppiä 1 (TRPV1), joka on herkkä korkeille lämpötilat ja matala pH.
Luurankolihaksen vapaat hermopäätteet näyttävät jakautuneen melko tasaisesti. Rotan gastrocnemius – soleus -lihaksen proksimaalisen ja distaalisen osan välillä ei havaittu eroa. Kuitenkin samassa tutkimuksessa rotan calcaneal-jänteen vatsakalvon hermotiheyden havaittiin olevan useita kertoja suurempi kuin GS-lihaksessa. Sitä vastoin varsinaisen jänteen kudoksen kollageenikimppuissa ei ollut melkein vapaita hermopäätteitä.
- Jänteet
Ihmisen Achilles-jänteiden innervaatio tarjoaa ympäröivien lihasten hermot ja ihon hermojen pienet fasciculit, mutta tähän liittyy kaikki hermopäätteet. Vapaat hermopäätteet ovat edustettuina jänteiden sisällä, mutta lähinnä peritendinoottisessa kudoksessa, ovat kipureseptorit. Kaikkien hermokuitujen ja hermopäätteiden määrä ja sijainti vaihtelevat jänteen toiminnan mukaan, ja ne ovat enemmän edustettuina pienissä jänteissä, joihin liittyy hienoja liikkeitä.
- Nivel
Nociceptorit nivelissä sijaitsevat nivelkapselissa, nivelsiteissä ja proksimaalisissa jänteissä, luussa, periosteumissa, nivelrasvapehmusteessa ja verisuonten ympärillä, mutta eivät nivelrustossa. Korkean kynnyksen nenäseptiset afferentit päättyvät ensisijaisesti nivel- ja periosteumiin ja reagoivat normaalisti vain nivelen liikkeeseen työrajojen ulkopuolella. Nivelvaurioiden jälkeen kaksi tekijää yhdistävät nivelreseptorien mekaanisen herkkyyden muuttamisen.Ensinnäkin fyysiset muutokset (nivelefuusio ja kudosödeema) muuttavat nivelkudoksiin kohdistuvia lepo- ja liikkeen aiheuttamia voimia, ja toiseksi vaurioituneen kudoksen sisällä vapautuneissa matory tulehduksellisissa välittäjissä herkistävät nikotioseptiset afferentit sitoutumalla hermopäätteiden reseptoreihin. Monet nivelen reseptorit reagoivat vaarattomiin liikkeisiin, mutta aktivoituvat yhä enemmän, kun liikkeet ylittävät fysiologisen työskentelyalueen, kun taas muut nociceptorit ovat aktiivisia yksinomaan haitallisten liikkeiden aikana. Kolmas ns. Hiljaisten nociceptorien ryhmä on normaalisti passiivinen ja reagoi vain patologisissa olosuhteissa, kuten fl ammentoinnissa.
Nasiseptorit ja proprioseptiiviset kuidut ovat osoittaneet, että lannerangan ulospäin suuntautuva nivelkapseli on runsaasti innervoitunut. Normaalissa tilassa nociceptoreilla, kuten fasettiliitoskapseleissa havaituilla, on korkea kynnysarvo, eikä niiden odoteta purkautuvan, ellei kuormitukset ole suprafysiologisia. Patologisen niveltulehduksen läsnä ollessa synovitis-kemialliset välittäjät voivat kuitenkin herkistää nämä notoseptorit, eikä suprafysiologisia stressitasoja enää tarvita kivun stimuloimiseksi. Tällaisia tulehduksellisia välittäjiä (aine P, bradykiniini, fosfolipaasi A2) on havaittu fasettiliitoskapseleissa.
Nikavaseptorit nikamavälilevyissä rajoittuvat yleensä rengasrenkaan ulkokolmannekseen. diskogeeniselle kivulle, kun ne laajenevat suuremmalle rengasmaiselle alueelle ja tunkeutuvat edelleen rappeutuneeseen levyyn verisuonia ja kiinnityksiä pitkin. Nämä C- ja A8-kiinnittimet ovat todennäköisesti vastuussa kipuvasteiden välittämisestä. Selkärangan takimmainen pitkittäinen nivelside ja ulommat rengasfibrosuskerrokset sisältävät runsaasti nenäseptisiä kiinnittimiä. Hermo-kuituja ja hermopäätteitä esiintyy myös zygapophysial-nivelten subondraalisessa luussa. Niitä esiintyy eroosiokanavissa, jotka ulottuvat subkondraalisesta luusta nivelrustoon.
Ihmisen tekemä tutkimus (Kiter et ai., 2010) osoitti sekä vapaat että kapseloidut hermopäätteet ihmisen iliolumbaraalisessa nivelsiteessä. Tutkimus (Hirsch et ai., 1963) ehdotti, että supraspinous- ja intraspinous-nivelsiteissä on tarkkoja hermosoluja ja monimutkaisia kapseloimattomia päätteitä.
- Viscera
Sisäelinten nenäseptorit eivät reagoi leikkaus- tai polttovammiin kuten perifeerisessä ihokudoksessa olevat kollegansa. Sen sijaan ne aktivoidaan vastauksena patologiseen muutokseen. Kipuja tuottavat ärsykkeet sisäelimissä, mukaan lukien vetovoima suolistossa, tulehdus, onttojen lihasseinäisten elinten kuten ruoansulatuskanavan, virtsateiden, sappirakon ja tällaisia onttoja elimiä ympäröivien lihaskerrosten voimakkaat supistukset, kemikaalit ärsyttävät aineet tai iskemia elimissä, kuten sydän. Näiden kannattimien jakauma vaihtelee elinten välillä. Korkean kynnyksen reseptorit yksinomaan innervoivat elimiä, joista kipu on ainoa tietoinen tunne (ts. Virtsajohdin, munuaiset, keuhkot, sydän), mutta niitä on suhteellisen vähän elimissä, jotka aiheuttavat vaarattomia ja haitallisia aistimuksia (esim. Paksusuoli, vatsa ja virtsarakko), innervoivat enimmäkseen matalan kynnyksen reseptorit. Elimillä, kuten maksalla, keuhkoilla, munuaisilla ja haimassa, on vähän reseptoreita, mutta näiden elinten kipu tulee lähinnä näiden elinten kapseleissa olevien reseptorien aktivoitumisesta. Sisäelinten nosiseptiivinen stimulaatio johtaa diffuusioon, jota on vaikea paikantaa. Sisäelinten afferentit notoseptiiviset kuidut löytyvät sympaattisten ja parasympaattisten hermojen yhteydessä. Suurin osa sisäelimistä innervoidaan vagaalisen hermon kautta, mutta tutkimukset eivät osoita selvästi, pystyykö tämä hermo kantamaan notoseptiivistä afferenttia syötettä vai ei. Jotkut tutkimukset osoittavat kuitenkin selvästi, että vagaaliset afferentit välittävät tietoa korkean intensiteetin mekaanisista ärsykkeistä keskushermostoon. Useat tutkimukset, joissa on käytetty ihmisiä tai eläimiä, ovat osoittaneet, että selkärangan vaurioituneet henkilöt pystyvät ilmoittamaan todennäköisesti sisäelinten alueelta peräisin olevasta kivusta.
- 1.0 1.1 Loeser JD, Treede RD. Kioton pöytäkirja IASP Basic kiputerminologiasta. Kipu. 2008; 137 (3): 473–7. doi: 10.1016 / j.pain.2008.04.025. PMID 18583048
- Basbaum AI, Jessell T.Kipun havaitseminen. Julkaisussa: Kandel ER, Schwartz J, Jessell T. toimittajat. Neurotieteen periaatteet. New York: Appleton ja Lange; 2000. s.472-491
- 3.0 3.1 3.2 3.3 3.4 3.5 Meyer RA, Ringkamp M, Campbell JN, Raja SN. Perifeeriset ihonotsiception mekanismit. Julkaisussa: McMahon SB, Koltzenburg M, toimittajat. Wall ja Melzackin kivun oppikirja. Lontoo: Elsevier; 2006. s. 3–34.
- Lloyd DPC. Neuronimallit, jotka hallitsevat ipsilateraalisten takarintarefleksien leviämistä kissassa. J Neurophysiol. 1943; 6: 293–315
- 5,0 5,1 5,2 Schaible HG, Schmidt RF. Kokeellisen niveltulehduksen vaikutukset hienojen nivelten afferenttiyksiköiden aistien ominaisuuksiin. Journal of Neurophysiology. 1985; 54: 1109-1122
- Häbler HJ, Jänig W, Koltzenburg M.Uuden tyyppinen myelinoimaton kemosensitiivinen nociceptor akuutisti tulehtuneessa virtsarakossa. Agentit ja toimet. 1988; 25: 219-221
- Tanelian DL. Sarveiskalvon afferenttien hermojen populaation kolinerginen aktivaatio. Kokeellinen aivotutkimus. 1991; 86: 414-420
- LaMotte RH, Campbell JN. Vertaus apinoiden lämpimien ja notiseptiivisten C-kuitu-afferenttien vastauksiin ihmisen termisen kivun arvioihin. Journal of Neurophysiology. 1978; 41: 509-528
- Treede RD, Meyer RA, Raja SN, Campbell JN. Todisteet kahdesta erilaisesta lämmönsiirtomekanismista notoseptiivisissä primäärisissä afferenteissa, jotka innervoivat apinan ihoa. Journal of Physiology. 1995; 483: 747-758
- Schepers RJ, Ringkamp M.Lämpöreseptorit ja lämpöherkät afferentit. Neurotiede & Biokäyttäytymistä koskevat arvostelut. 2010; 34 (2): 177-184
- Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D.Kapsaisiinireseptori: lämpöaktivoitu ionikanava kivun reitillä. Luonto 1997; 389: 816–824
- Bjur D, Alfredson H, Forsgren S. Ihmisen akillesjänteen innervointimalli: normaalin ja jänteen jänteen tutkimukset yleisen ja aistinvaraisen innervaation markkereilla. Solukudoksen res. 2005; 320: 201-206
- 13.0 13.1 Ashton IK, Ashton BA, Gibson SJ, Polak JM, Jaffray DC, Eisenstein SM. Selkäkivun morfologinen perusta: hermosolujen ja neuropeptidien osoittaminen lannerangan nivelsidekapselissa, mutta ei ligamentum fl avumissa. J Orthop Res. 1992; 10 (1): 72-78.
- Kiter E, Karaboyun T, Tufan AC, Acar K. ImmunohistochemicalfckLR vapaiden hermopäätteiden esittely iliolumbal-nivelsiteessä. Selkä. 2010; 35 (4): E101-4. doi: 10.1097 / BRS.0b013e3181ae561d.
- Hirsch C, Ingelmark BE, Miller M.Anatominen perusta lowfckLRback-kivulle. Tutkimukset aistihermopäätteiden läsnäolosta infckLRligamentous, kapselin ja nikamien väliset levyrakenteet thefckLRhuman lannerangassa. Acta Orthop Scand. 1963; 33: 1–17.
- Moller, Aage (22.4.2014). Kipu, sen anatomia, fysiologia ja hoito. Kindle-versio.
