Los nociceptores pueden activarse mediante tres tipos de estímulos dentro del tejido objetivo: temperatura (térmica), mecánica (por ejemplo, estiramiento / tensión) y química (por ejemplo, cambio de pH como resultado de un proceso inflamatorio local). Por lo tanto, un estímulo nocivo se puede clasificar en uno de estos tres grupos.
Los términos nocicepción y dolor no deben usarse como sinónimos, porque cada uno puede ocurrir sin el otro. El dolor que surge de la activación de los nociceptores se llama dolor nociceptivo. El dolor nociceptivo se puede clasificar según el tejido en el que se produjo la activación del nociceptor: somático superficial (p. Ej., Piel), somático profundo (p. Ej. Ligamentos / tendones / huesos / músculos) o visceral (órganos internos).
Vía de nocicepción
No todos los nociceptores responden a cada tipo de estímulos nocivos. La aparente falta de respuesta a un estímulo nocivo puede deberse a diferentes receptores ubicados en la membrana del extremo terminal (terminación nerviosa libre) o la intensidad del estímulo es insuficiente. Por lo general, el umbral de estimulación de un nociceptor está por debajo de la intensidad de daño tisular. Los nociceptores tienen propiedades heterogéneas, respondiendo a múltiples modalidades de estímulo (polimodal). Sin embargo, la aplicación de estímulos nocivos de una modalidad puede alterar las propiedades de respuesta del nociceptor a otras modalidades. Además, la aplicación de un estímulo particular durante un período de tiempo determinado puede inducir cambios a largo plazo en las propiedades de respuesta del nociceptor. La lesión y la inflamación disminuyen el umbral y aumentan la magnitud de la respuesta a un estímulo dado, fenómeno conocido como sensibilización periférica. De particular interés son los aferentes amielínicos sensibles al calor, pero mecánicamente insensibles, que desarrollan sensibilidad mecánica sólo en el contexto de una lesión.
Los nociceptores tienen el aspecto morfológico de terminaciones nerviosas libres. El término «terminación nerviosa libre» indica que en el microscopio óptico no se puede reconocer ninguna estructura receptiva (corpuscular). En la actualidad, no existen diferencias ultraestructurales claras entre las terminaciones nerviosas libres no nociceptivas (p. Ej., Mecanorreceptores sensibles y termorreceptores) y las nociceptivas . Funcionalmente, diferentes terminaciones nerviosas libres
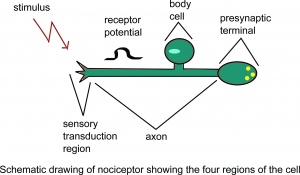
Dibujo esquemático del nociceptor que muestra el cuatro regiones de la célula.
se supone que poseen diferentes conjuntos de moléculas receptoras en su membrana axonal. Las moléculas receptoras que son particularmente importantes para la función de los nociceptores musculares son los canales iónicos sensibles al ácido (ASIC) que se abren a un pH tisular bajo, receptores P2X3 que se activan mediante la unión de trifosfato de adenosina (ATP) y el receptor potencial transitorio subtipo 1 (TRPV1) que es sensible a altas temperaturas, capsaicina química y pH bajo. La sustancia neuropéptida P tiene se ha informado que está presente predominantemente en fibras aferentes nociceptivas. Si bien existen numerosos neurotransmisores dentro del sistema nervioso, los tres que participan más comúnmente en la transmisión nociceptiva son péptidos, purinas y aminoácidos excitadores (EAA). Los EAA, en particular el glutamato, producen la respuesta excitadora inicial en la neurona postsináptica de segundo orden, seguida de la liberación de péptidos, incluida la sustancia P, lo que provoca una despolarización más prolongada y una transmisión nociceptiva sostenida
Hay nociceptores presentes en muchos tejidos corporales, pero no se han encontrado en el cartílago articular, la pleura visceral, el parénquima pulmonar, el pericardio, el cerebro y el tejido del cordón.
Tipos de nociceptores
Varias clases de Se han descrito nociceptores. Algunos nociceptores responden al frío nocivo, al calor nocivo y a estímulos mecánicos de umbral alto, así como a una variedad de mediadores químicos. Los nociceptores, aunque polimodales, se pueden dividir en dos clases principales sobre la base de la respuesta a estímulos mecánicos, lo que lleva a una distinción entre aferentes mecánicamente sensibles (MSA) y aferentes mecánicamente insensibles (MIA) definidos como aferentes que tienen umbrales mecánicos muy altos o no responden a los estímulos mecánicos.
Los nociceptores se pueden clasificar por la velocidad de conducción de sus axones o el diámetro de las fibras, este es el grupo III y IV o Aδ y C respectivamente.
Aferentes mielinizados de diámetro medio de tipo Aδ que median el dolor agudo, bien localizado y punzante, conocido como aferente del grupo III. Las fibras aferentes Aδ tienen un diámetro medio de fibra de 2 a 5 mm y una velocidad de conducción de 5 a 30 m / s. Los nociceptores Aδ se pueden dividir en dos tipos (parece existir aproximadamente el 50% de cada tipo)
- El tipo I Aδ son aferentes mecánicamente sensibles (MSA) que responden con una descarga de adaptación lenta a fuertes puntuar la presión.También responden al calor y a los estímulos químicos y tienen umbrales de calor relativamente altos (> 50C).
- Los nociceptores de tipo II Aδ tienen un umbral de calor más bajo que las unidades de tipo I, pero tienen umbrales mecánicos muy altos (llamados aferentes mecánicamente insensibles – MIA). Es casi seguro que la actividad de este aferente media la «primera» respuesta de dolor agudo al calor nocivo. Se han informado en la articulación de la rodilla, las vísceras y la córnea.
Fibras aferentes amielínicas tipo C que transmiten El dolor sordo, ardiente y mal localizado, llamado «segundo» o dolor lento, se conoce como grupo IV. El diámetro medio de la fibra es inferior a 2 mm y la velocidad de conducción es de 2 m / so menos. Las fibras C amielínicas también son heterogéneas. Los aferentes de fibra C se pueden dividir en dos clases según su respuesta a los estímulos mecánicos. Al igual que las fibras aferentes Aδ mielinizadas, la mayoría de las fibras C son polimodales, es decir, incluyen una población que es tanto mecánica como sensible al calor (CMH). La respuesta de los CMH también está fuertemente influenciada por el historial de estímulos. Se observan fatiga y sensibilización. También se observa una disminución en la respuesta al calor tras los estímulos mecánicos aplicados al campo receptivo o los estímulos eléctricos aplicados al tronco nervioso. Esto sugiere que la fatiga en respuesta a una modalidad de estímulo dada puede ser inducida por estimulación heteróloga, es decir, por excitación con un estímulo de una modalidad diferente. Estos son el tipo predominante de nociceptores de fibra C en la piel de los mamíferos. Las fibras C mecánicamente insensibles (C-MIA) no responden a los estímulos mecánicos o tienen un umbral mecánico muy alto. Estos aferentes responden al calor y a diversos estímulos químicos nocivos (p. Ej., Capsaicina, histamina) y a menudo se consideran quimiorreceptores.
En resumen, la sensación de dolor inmediata, bien localizada y tacaña es mediada por fibras nerviosas mielinizadas de pequeño diámetro, tipo Aδ. Las fibras C median un tipo de dolor mal localizado anatómicamente, tiene un carácter doloroso y ardiente, llega más tarde que la primera sensación inicial y es difícil estimar su fuerza.
Canales TRP
Los nociceptores responden a cierto rango de temperatura y estímulos mecánicos.
El extremo periférico del axón contiene proteínas encapsuladas llamadas proteínas de transducción (TRP), que pueden ser activadas por un estímulo específico. La superfamilia multigénica del potencial receptor transitorio (TRP) codifica proteínas integrales de membrana que funcionan como canales iónicos. La familia de canales TRP es de interés porque varios miembros han sido implicados en la transducción de señales de los nociceptores. Los nociceptores de fibras Aδ y C detectan estímulos nocivos de frío y calor nocivos. La familia de canales TRP proporciona un grupo de moléculas equipadas para detectar cambios térmicos. El rango completo de temperaturas, desde el frío nocivo hasta el calor nocivo, parece ser transducido por la actividad en estos canales iónicos. TRPM8 y TRPV3 / 4 codifican frío y cálido, respectivamente, TRPA1 transduce frío nocivo y TRPV1 / 2 detecta calor nocivo. Algunos de los canales de TRP termosensibles también responden a estímulos químicos y mecánicos.
Por ejemplo, TRPV1 es esencial para transducir el nociceptivo por los efectos inflamatorios e hipotérmicos de los compuestos vanilloides y contribuye a la nocicepción térmica aguda y la hiperalgesia térmica después de una lesión tisular. La corriente TRPV1 es potenciada por la bradicinina y el factor de crecimiento nervioso a través de varios mecanismos posibles y también es activada por protones y capsaicina, el compuesto «picante» en los chiles. A diferencia de la hiperalgesia que sigue a estímulos nocivos intensos, la exposición prolongada a la capsaicina puede provocar una desensibilización posterior.
Si bien el descubrimiento de los canales de TRP termosensibles ha mejorado enormemente nuestra comprensión de los mecanismos de transducción de los estímulos térmicos, los hallazgos en animales con deleciones selectivas de genes claramente indican que los estímulos térmicos intervienen en múltiples mecanismos de transducción aún desconocidos.
Mediadores químicos
La lesión provoca la liberación local de numerosas sustancias químicas de las células no neuronales (p. ej., fibroblastos, mastocitos, neutrófilos, monocitos y plaquetas), así como de las terminales sensoriales de las fibras aferentes primarias. que median o facilitan el proceso inflamatorio. Los mediadores inflamatorios incluyen prostaglandinas, leucotrienos, bradicinina, serotonina, histamina, SP, tromboxanos, factor activador de plaquetas, purinas como adenosina y ATP, protones y radicales libres. Durante la inflamación también se generan citocinas, como interleucinas y factor de necrosis tumoral, y neurotrofinas, especialmente NGF.Vale la pena señalar que la mayoría de esas sustancias químicas (principalmente sustancias como la bradicinina y la prostaglandina E2) generalmente se considera que no activan los nociceptores directamente, sino que mejoran la sensación de dolor en respuesta a estímulos naturales y otras sustancias químicas endógenas al aumentar la frecuencia de acción. disparo potencial.
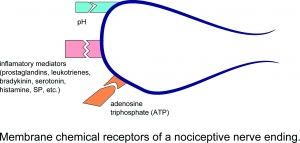
Receptores químicos de membrana de una terminación nerviosa nociceptiva.
La activación de los nociceptores no solo transmite mensajes aferentes al asta dorsal de la médula espinal, sino que también inicia el proceso de inflamación neurogénica. La inflamación neurogénica provoca la liberación de neurotransmisores, en particular la sustancia P y el péptido relacionado con el gen de la calcitonina (CGRP), que conduce a una vasodilatación grave, así como a la pérdida de proteínas y líquido plasmático de las vénulas poscapilares.
Dos sustancias químicas son de particular interés:
- Trifosfato de adenosina (ATP)
El ATP es la molécula que transporta energía en todas las células del cuerpo. Se libera de todos los tejidos durante el trauma y otros cambios patológicos asociados con la muerte celular. Por esta razón, el ATP se ha considerado una sustancia de señal general para el trauma y el dolor tisular. En estudios microneurográficos humanos, la inyección de ATP activó el 60% de las fibras C-nociceptivas mecano-sensibles y mecano-insensibles sin sensibilizar estas fibras a estímulos mecánicos o térmicos. El ATP activa los receptores P2X3 purinérgicos en los nociceptores provocando una secreción. El ATP es particularmente importante para el dolor muscular porque está presente en las células musculares en alta concentración.
- Alteración de protones en el pH tisular
Los canales iónicos sensibles al ácido (ASIC) constituyen una familia de moléculas receptoras que son sensibles a una caída del pH y se abren a varios valores de pH. Las proteínas del canal reaccionan a cambios de pH ya demasiado pequeños. Esta familia de receptores (por ejemplo, ASIC1 y ASIC3) es particularmente importante para el dolor muscular porque casi todos los cambios patológicos en el músculo van acompañados de una caída del pH tisular, por ejemplo, ejercicio agotador, isquemia e inflamación.
Ubicación de los nociceptores
Los cuerpos celulares de los nociceptores están ubicados en los ganglios de la raíz dorsal (GRD) para la periferia y el ganglio trigémino para la cara. Sus axones se extienden hacia el sistema nervioso periférico y terminan en ramas creando campos receptivos.
- Piel
Las terminaciones nerviosas libres que terminan en la piel son la maquinaria para señalar los cambios mecánicos, térmicos y químicos locales. La gran mayoría de las terminaciones nerviosas libres de la piel se denominan nociceptores polimodales porque contienen múltiples receptores y, por tanto, responden a diversas combinaciones de los estímulos mencionados anteriormente. Las unidades de mecanorreceptores de alto umbral de tipo I Aδ están densamente distribuidas en la piel vellosa y glabra.
- Músculos
Moléculas receptoras que son particularmente importantes para la La función de los nociceptores musculares son los canales iónicos sensibles al ácido (ASIC) que se abren a un pH tisular bajo, los receptores P2X3 que se activan al unirse al trifosfato de adenosina (ATP) y el receptor de potencial transitorio subtipo 1 (TRPV1) que es sensible a temperaturas y pH bajo.
En el músculo esquelético, las terminaciones nerviosas libres parecen estar distribuidas de manera bastante uniforme. No se encontraron diferencias entre las porciones proximal y distal del músculo gastrocnemio-sóleo de rata. Sin embargo, en el mismo estudio, se encontró que la densidad de las fibras nerviosas en el peritendino del tendón calcáneo de la rata era varias veces mayor que en el músculo GS. En contraste, los haces de fibras de colágeno del tejido del tendón propiamente dicho estaban casi libres de terminaciones nerviosas libres.
- Tendones
Inervación de los tendones de Aquiles humano Lo proporcionan los nervios de los músculos circundantes y los pequeños fascículos de los nervios cutáneos, pero esto afecta a todas las terminaciones nerviosas. Las terminaciones nerviosas libres están representadas dentro de los tendones, pero principalmente en el tejido peritendinoso, son receptores del dolor. El número y la ubicación de todas las fibras nerviosas y terminaciones nerviosas varían según la función del tendón, estando más representados en los tendones más pequeños involucrados en movimientos finos.
- Articulación
Los nociceptores en las articulaciones se encuentran dentro de la cápsula articular, los ligamentos y los tendones proximales, el hueso, el periostio, la almohadilla grasa articular y alrededor de los vasos sanguíneos, pero no en el cartílago articular. Los aferentes nociceptivos de umbral alto terminan principalmente en la membrana sinovial y el periostio y normalmente responden sólo al movimiento de la articulación más allá de los límites de trabajo. Tras el daño articular, dos factores se combinan para alterar la sensibilidad mecánica de los nociceptores articulares.Primero, los cambios físicos (derrame articular y edema tisular) alteran las fuerzas en reposo e inducidas por el movimiento ejercidas sobre los tejidos articulares, y segundo, los mediadores inflamatorios liberados dentro del tejido dañado sensibilizan a las aferentes nociceptivas articulares al unirse a receptores en las terminaciones nerviosas. Muchos nociceptores de la articulación responden a movimientos inocuos, pero se activan cada vez más cuando los movimientos superan el rango de trabajo fisiológico, mientras que otros nociceptores están activos exclusivamente durante movimientos nocivos. El tercer grupo de los denominados nociceptores silenciosos normalmente está inactivo y responde sólo en circunstancias patológicas como la inflamación.
Se ha demostrado que la cápsula de la articulación facetaria lumbar está ricamente inervada por nociceptores y fibras propioceptivas. En un estado normal, los nociceptores como los que se observan en la cápsula de la articulación facetaria tienen un umbral alto y no se espera que se descarguen a menos que las cargas sean suprafisiológicas. Sin embargo, en presencia de inflamación articular patológica, los mediadores químicos de la sinovitis pueden sensibilizar a estos nociceptores y es posible que ya no se requieran niveles suprafisiológicos de estrés para estimular el dolor. Dichos mediadores inflamatorios (sustancia P, bradicinina, fosfolipasa A2) se han detectado en la cápsula de la articulación facetaria.
Los nociceptores en los discos intervertebrales normalmente se limitan al tercio externo del anillo, podría ser el sustrato para el dolor discogénico cuando se expanden sobre el área anular más grande y penetran más en el disco degenerado a lo largo de la vasculatura y las fisuras. Esas fibras C y A δ probablemente sean responsables de transmitir las respuestas al dolor. El ligamento longitudinal posterior y las capas fibrosas del anillo externo del disco intervertebral contienen muchas fibras nociceptivas. Las fibras nerviosas y las terminaciones nerviosas también se encuentran en el hueso subcondral de las articulaciones cigapofisarias. Ocurren en canales de erosión que se extienden desde el hueso subcondral hasta el cartílago articular.
Un estudio en humanos realizado por (Kiter et al., 2010) mostró terminaciones nerviosas tanto libres como encapsuladas en el ligamento iliolumbar humano. Un estudio de (Hirsch et al., 1963) sugirió la presencia de fibras nerviosas finas y terminaciones complejas no encapsuladas en los ligamentos supraespinosos e intraespinosos.
- Viscera
Los nociceptores viscerales no responden a lesiones por cortes o quemaduras como sus contrapartes en el tejido cutáneo periférico. En cambio, se activan en respuesta a cambios patológicos. Estímulos que producen dolor en las vísceras, incluida la tracción en el mesenterio, inflamación, distensión de órganos huecos de paredes musculares como el tracto gastrointestinal, urinario, vesícula biliar y fuertes contracciones de las capas musculares que rodean dichos órganos huecos, sustancias químicas irritantes o isquemia en órganos como el corazón. La distribución de estas fibras varía entre órganos. Los receptores de umbral alto inervan exclusivamente órganos de los que el dolor es la única sensación consciente (es decir, uréter, riñón, pulmones, corazón), pero son relativamente pocos en los órganos que proporcionan sensaciones inocuas y nocivas (p. Ej., Colon, estómago y vejiga). inervado principalmente por receptores de bajo umbral. Los órganos, como el hígado, los pulmones, los riñones y el páncreas, tienen pocos receptores, pero el dolor de estos órganos proviene principalmente de la activación de los receptores en las cápsulas de estos órganos. La estimulación nociceptiva de las vísceras provoca un dolor difuso que es difícil de localizar. Las fibras nociceptivas aferentes en las vísceras se encuentran asociadas con los nervios simpático y parasimpático. La mayoría de los órganos viscerales están inervados por el nervio vago, pero los estudios no muestran claramente si este nervio es capaz o no de transportar impulsos aferentes nociceptivos. Sin embargo, algunos estudios demuestran claramente que las aferencias vagales transmiten información sobre estímulos mecánicos de alta intensidad al sistema nervioso central. Varios estudios en los que participaron seres humanos o animales han demostrado que los sujetos con lesión de la columna vertebral pueden informar que el dolor se origina probablemente en el área de los órganos viscerales.
- 1.0 1.1 Loeser JD, Treede RD. El protocolo de Kyoto de Terminología Básica del Dolor de la IASP. Dolor. 2008; 137 (3): 473–7. doi: 10.1016 / j.pain.2008.04.025. PMID 18583048
- Basbaum AI, Jessell T. La percepción del dolor. En: Kandel ER, Schwartz J, Jessell T. editores. Principios de neurociencia. Nueva York: Appleton y Lange; 2000. p472-491
- 3,0 3,1 3,2 3,3 3,4 3,5 Meyer RA, Ringkamp M, Campbell JN, Raja SN. Mecanismos periféricos de la nocicepción cutánea. En: McMahon SB, Koltzenburg M, editores. Wall y Melzack’s Textbook of Pain. Londres: Elsevier; 2006. p3–34.
- Lloyd DPC. Patrones de neuronas que controlan la transmisión de los reflejos ipsilaterales de las patas traseras en el gato. J Neurophysiol. 1943; 6: 293–315
- 5,0 5,1 5,2 Schaible HG, Schmidt RF. Efectos de una artritis experimental sobre las propiedades sensoriales de las unidades aferentes articulares finas. Revista de neurofisiología. 1985; 54: 1109-1122
- Häbler HJ, Jänig W, Koltzenburg M.Un nuevo tipo de nociceptor quimiosensible amielínico en la vejiga urinaria agudamente inflamada. Agentes y acciones. 1988; 25: 219-221
- Tanelian DL. Activación colinérgica de una población de nervios aferentes corneales. Investigación experimental del cerebro. 1991; 86: 414-420
- LaMotte RH, Campbell JN. Comparación de las respuestas de aferentes de fibra C cálidos y nociceptivos en monos con juicios humanos de dolor térmico. Revista de neurofisiología. 1978; 41: 509-528
- Treede RD, Meyer RA, Raja SN, Campbell JN. Evidencia de dos mecanismos de transducción de calor diferentes en aferentes primarios nociceptivos que inervan la piel de mono. Revista de fisiología. 1995; 483: 747-758
- Schepers RJ, Ringkamp M. Termorreceptores y aferentes termosensibles. Neurociencia & Reseñas de bioconducta. 2010; 34 (2): 177-184
- Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. El receptor de capsaicina: un canal iónico activado por calor en la vía del dolor. Nature 1997; 389: 816–824
- Bjur D, Alfredson H, Forsgren S. El patrón de inervación del tendón de Aquiles humano: estudios del tendón normal y de la tendinosis con marcadores de inervación general y sensorial. Cell Tissue Res. 2005; 320: 201-206
- 13.0 13.1 Ashton IK, Ashton BA, Gibson SJ, Polak JM, Jaffray DC, Eisenstein SM. Base morfológica del dolor de espalda: demostración de fibras nerviosas y neuropéptidos en la cápsula de la articulación facetaria lumbar, pero no en el ligamento fl avum. J Orthop Res. 1992; 10 (1): 72-78
- Kiter E, Karaboyun T, Tufan AC, Acar K. ImmunohistochemicalfckLR demostración de terminaciones nerviosas libres en el ligamento iliolumbar. Columna vertebral. 2010; 35 (4): E101-4. doi: 10.1097 / BRS.0b013e3181ae561d.
- Hirsch C, Ingelmark BE, Miller M. La base anatómica para el dolor de espalda baja. Estudios sobre la presencia de terminaciones nerviosas sensoriales en estructuras de disco ligamentosas, capsulares e intervertebrales en la columna lumbar humana. Acta Orthop Scand. 1963; 33: 1-17.
- Moller, Aage (22 de abril de 2014). El dolor, su anatomía, fisiología y tratamiento. Versión Kindle.
