侵害受容器は、標的組織内の3種類の刺激(温度(熱)、機械的(例:ストレッチ/ひずみ)、化学的(例:pH変化))によって活性化されます。局所炎症過程の結果として)。したがって、有害な刺激はこれら3つのグループのいずれかに分類することができる。
侵害受容経路
すべての侵害受容器が各タイプに反応するわけではありません有害な刺激の。有害な刺激に対する反応の明らかな欠如は、末端の膜(自由神経終末)にある異なる受容体のために生じるか、刺激の強さが不十分である可能性がある。通常、侵害受容器の刺激閾値は、組織損傷の強度を下回っている。侵害受容器は不均一な特性を持ち、複数の刺激のモダリティに反応する。しかし、1つのモダリティに対する有害刺激の適用は、他のモダリティに対する侵害受容器の応答特性を変更する可能性がある。また、特定の刺激を与えられた時間だけ適用することは、侵害受容器の応答特性に長期的な変化をもたらす可能性がある。傷害と炎症は、所与の刺激に対する閾値を減少させ、応答の大きさを増大させる。これは末梢感作として知られる現象である。特に興味深いのは、熱に反応するが、機械的に鈍感な無髄求心性神経であり、損傷の状況でのみ機械的感受性を発達させる。
侵害受容器は、自由神経末端の形態学的外観を有する。 「自由神経終末」という用語は、光学顕微鏡では(粒子の)受容構造を認識できないことを示します。現在、非侵害受容性の自由神経終末(例えば、敏感な機械受容器および熱受容器)と侵害受容性のものとの間に明確な超微細構造の違いはありません。 。機能的には、さまざまな自由神経終末
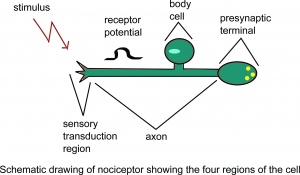
侵害受容器の概略図細胞の4つの領域。
軸膜に異なる受容体分子のセットを持っていると想定されています。筋肉侵害受容器の機能に特に重要な受容器分子は、酸を感知するイオンチャネルです。 (ASIC)は、低い組織pHで開き、アデノシン三リン酸(ATP)の結合によって活性化されるP2X3受容体、および高温、カプサイシン化学物質、および低pHに敏感な一過性受容器電位受容器サブタイプ1(TRPV1)です。神経ペプチド物質Pはこれらは、主に侵害受容性求心性線維に存在することが報告されている。神経系内には多数の神経伝達物質があるが、侵害受容伝達に関与する最も一般的な3つは、ペプチド、プリン、および興奮性アミノ酸(EAA)である。 EAA、特にグルタメートは、シナプス後の二次ニューロンで最初の興奮性応答を引き起こし、続いてサブスタンスPを含むペプチドを放出し、より長期の脱分極と持続的な侵害受容伝達を引き起こします
侵害受容器が存在します多くの体組織に見られますが、関節軟骨、内臓胸膜、肺実質、心膜、脳、臍帯組織には見られません。
侵害受容器の種類
いくつかのクラスの侵害受容器が記載されている。一部の侵害受容器は、有害な寒さ、有害な熱、高閾値の機械的刺激、およびさまざまな化学的メディエーターに反応します。侵害受容器は、多峰性ではあるが、機械的刺激への応答に基づいてさらに2つの主要なクラスに分類でき、機械的に敏感な求心性神経(MSA)と、機械的閾値が非常に高い求心性神経として定義される機械的に鈍感な求心性神経(MIA)を区別します。機械的刺激に反応しません。
侵害受容器は、軸索の伝導速度または線維の直径によって分類できます。これは、それぞれグループIIIおよびIVまたはAδおよびCです。
タイプAδの中径の有髄求心性神経は、グループIII求心性神経として知られる、急性で、局所性が高く、鋭い刺すようなタイプの痛みを媒介します。 Aδ求心性線維の平均径は2-5mmで、伝導速度は5-30m / sである。 Aδ侵害受容器はさらに2つのタイプに分けることができます(各タイプの約50%に存在するようです)
- タイプIAδは機械的に敏感な求心性神経(MSA)であり、ゆっくりと強い放電に適応します。句読点の圧力。それらはまた、熱および化学的刺激に応答し、比較的高い熱閾値を持っています(> 50C)。タイプIIAδ侵害受容器はタイプIユニットよりも熱閾値が低いが、非常に高い機械的閾値を持つ(MIAsと呼ばれる)。この求心性神経の活動は、ほぼ確実に、有害な熱に対する「最初の」急性の痛みの反応を仲介します。これらは、膝関節、内臓、角膜で報告されています。
C型無髄求心性線維局所化が不十分な鈍い、灼熱感、いわゆる「第2の」または遅い痛みは、グループIVとして知られています。平均繊維径は2mm以下であり、導電速度は2m / s以下である。無髄性C線維もまた不均一である。 C線維求心性神経は、機械的刺激に対する応答に基づいて2つのクラスに分類することができる。有髄Aδ求心性線維と同様に、ほとんどのC線維は多峰性、すなわち、機械的および熱に敏感な集団(CMH)を含む。 CMHの応答は刺激履歴の影響を強く受けます。疲労と感作の両方が観察される。熱に対する応答の低下は、受容野に加えられた機械的刺激または神経幹に加えられた電気的刺激の後にも観察されます。これは、所与の刺激モダリティに応答する疲労が、異種刺激によって、すなわち、異なるモダリティの刺激による興奮によって誘発され得ることを示唆している。これらは、哺乳類の皮膚におけるC線維侵害受容器の主なタイプです。機械的に鈍感なC線維(C-MIA)は、機械的刺激に反応しないか、非常に高い機械的閾値を持っています。これらの求心性神経は、熱やさまざまな有害な化学刺激(カプサイシン、ヒスタミンなど)に反応し、化学受容器と見なされることがよくあります。
上記を要約すると、即時の、十分に局所化された、けちな痛みの感覚は小径の有髄神経線維、Aδ型によって媒介されます。 C線維は、局所化が不十分な解剖学的タイプの痛みを媒介し、痛みと灼熱感があり、最初の最初の感覚よりも遅くなり、その強度を推定することは困難です。
TRPチャネル
侵害受容器は特定の温度範囲と機械的刺激に反応します。
軸索の末梢端には、特定の刺激によって活性化できる形質導入タンパク質(TRP)と呼ばれるカプセル化されたタンパク質が含まれています。一過性受容器電位(TRP)マルチ遺伝子スーパーファミリーは、イオンチャネルとして機能する内在性膜タンパク質をコードします。いくつかのメンバーが侵害受容器のシグナル伝達に関与しているため、TRPチャネルファミリーは興味深いものです。
有害な寒冷および有害な熱刺激は、AδおよびC線維侵害受容器によって検出されます。 TRPチャネルファミリーは、熱変化を検出するために装備された分子のグループを提供します。有害な寒さから有害な熱までの全範囲の温度は、これらのイオンチャネルの活性によって変換されるように見えます。 TRPM8とTRPV3 / 4はそれぞれ涼しいと暖かいをエンコードし、TRPA1は有害な寒さを変換し、TRPV1 / 2は有害な熱を感知します。一部の感熱性TRPチャネルは、化学的および機械的刺激にも反応します。
たとえば、TRPV1は、バニロイド化合物の炎症性および低体温性効果による侵害受容の伝達に不可欠であり、組織損傷後の急性熱侵害受容および熱痛覚過敏に寄与します。 TRPV1電流は、ブラジキニンと神経成長因子によっていくつかの可能なメカニズムを介して増強され、プロトンとカプサイシン、唐辛子の「ホット」化合物によっても活性化されます。激しい侵害刺激後の痛覚過敏とは対照的に、カプサイシンへの長期暴露はその後の脱感作を引き起こす可能性があります。
感熱性TRPチャネルの発見により、熱刺激の伝達メカニズムの理解が大幅に向上しましたが、選択的遺伝子欠失のある動物での所見は複数のまだ未知の伝達メカニズムが熱刺激によって関与していることを示します。
化学メディエーター
損傷により、非神経細胞(線維芽細胞、肥満細胞、好中球、単球、血小板など)や、一次求心性線維の感覚終末から多数の化学物質が局所的に放出されます。炎症過程を仲介または促進します。炎症性メディエーターには、プロスタグランジン、ロイコトリエン、ブラジキニン、セロトニン、ヒスタミン、SP、トロンボキサン、血小板活性化因子、アデノシンやATPなどのプリン、プロトン、フリーラジカルが含まれます。インターロイキンや腫瘍壊死因子などのサイトカイン、およびニューロトロフィン、特にNGFも炎症中に生成されます。これらの化学物質(主にブラジキニンやプロスタグランジンE2などの物質)のほとんどは、侵害受容器を直接活性化するのではなく、作用の頻度を増やすことによって自然の刺激や他の内因性化学物質に反応して痛みの感覚を高めると一般に考えられていることに注意してください。発火の可能性。
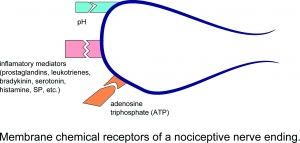
侵害受容神経終末の膜化学受容体。
侵害受容器の活性化は、求心性メッセージを脊髄の後角に伝達するだけでなく、神経性炎症のプロセスを開始します。神経性炎症は、神経伝達物質、特にサブスタンスPとカルシトニン遺伝子関連ペプチド(CGRP)の放出を引き起こし、重度の血管拡張、および毛細血管後の小静脈からのタンパク質と体液の血漿漏出を引き起こします。
特に興味深い2つの化学物質:
- アデノシン三リン酸(ATP)
ATPはエネルギーを運ぶ分子です体のすべての細胞で。細胞死に伴う外傷やその他の病理学的変化の間に、すべての組織から放出される。このため、ATPは組織の外傷や痛みのための一般的なシグナル物質と考えられてきた。ヒトの微小神経造影研究では、ATPの注射は機械的応答性および機械的非感受性のC-ノセチス性繊維の60%を活性化したが、機械的または熱的刺激に対してこれらの繊維を感知することはなかった。 ATPは侵害受容器のプリン作動性P2X3受容体を活性化し、分泌物を引き起こします。 ATPは筋肉細胞に高濃度で存在するため、筋肉痛にとって特に重要である。
- 組織のpHのプロトン変化
酸感受性イオンチャネル(ASIC)は、pHの低下に敏感で、開いている受容体分子のファミリーを構成しますさまざまなpH値で。チャネルタンパク質は既に小さすぎるpHの変化に反応する。この受容体ファミリー(たとえば、ASIC1およびASIC3)は、筋肉のほとんどすべての病理学的変化が組織のpHの低下を伴うため、筋肉痛にとって特に重要です。たとえば、激しい運動、虚血、および炎症です。
侵害受容器の位置
侵害受容器の細胞体は、末梢では後根神経節(DRG)に、顔では三叉神経節に位置しています。これらの軸索は末梢神経系に広がり、受容野を形成する枝で終了する。
- 皮膚
extern皮膚で終わる自由な神経終末は、局所的な機械的、熱的、および化学的変化を知らせるための機構である。皮膚の自由神経終末の大部分は、多峰性侵害受容器と呼ばれる。タイプIAδの高閾値機械受容体ユニットは、毛深い、そして無毛の皮膚に密に分布しています。
- 筋肉
特に重要な受容体分子筋侵害受容器の機能は、低組織pHで開く酸感知イオンチャネル(ASIC)、アデノシン三リン酸(ATP)の結合によって活性化されるP2X3受容体、および高に敏感な一過性受容体電位受容体サブタイプ1(TRPV1)です。温度と低pH。
骨格筋では、自由神経終末が非常に均一に分布しているように見えます。ラットの腓腹筋 – ヒラメ筋の近位部と遠位部の間に違いは見られなかった。しかし、同じ研究では、ラット踵骨腱の腹膜の神経線維密度は、GS筋のそれよりも数倍高いことが見出された。対照的に、本来の腱組織のコラーゲン線維束には、自由な神経終末がほとんどありませんでした。
- 腱
人間のアキレス腱の神経支配周囲の筋肉からの神経と皮膚神経からの小さな束によって提供されますが、これにはすべての神経終末が含まれます。自由神経終末は腱の内側に表現されるが、主に腱周囲組織には痛み受容体がある。すべての神経線維と神経終末の数と位置は腱の機能によって異なり、細かい動きに関与する小さな腱でより多く表されます。
- 関節
関節の侵害受容器は、関節カプセル、靭帯、近位腱、骨、骨膜、関節脂肪パッド内、および血管の周囲にありますが、関節軟骨にはありません。高い閾値の侵害受容性求心性神経は、主に滑膜と骨膜で終了し、通常は動作限界を超えた関節の動きにのみ反応する。関節の損傷に続いて、2つの要因が組み合わさって関節侵害受容器の機械的感度を変化させる。第一に、物理的変化(関節滲出液および組織浮腫)は、関節組織に作用する安静時および運動誘発性の力を変化させ、第二に、損傷した組織内で放出される炎症性メディエーターは、神経終末の受容体に結合することによって関節侵害受容求心性神経を感作します。関節の多くの侵害受容器は無害な動きに反応するが、動きが生理的動作範囲を超えるとますます活性化されるが、他の侵害受容器は有害な動きの間だけ活性化される。腰椎椎間関節包は、侵害受容器と固有受容性繊維によって豊富に神経支配されていることが実証されている。通常の状態では、椎間関節包に見られるような侵害受容器は高い閾値を持ち、負荷が超生理学的でない限り放電することは期待されないだろう。しかし、病的な関節の炎症の存在下では、滑膜炎の化学的メディエーターがこれらの侵害受容器を感作する可能性があり、痛みを刺激するために超生理学的レベルのストレスがもはや必要とされない可能性があります。このような炎症性メディエーター(サブスタンスP、ブラジキニン、ホスホリパーゼA2)は、椎間関節包で検出されています。
椎間板の侵害受容器は通常、線維輪の外側3分の1に限定され、基質である可能性があります。それらがより大きな環状領域に拡大し、血管系および裂傷に沿って変性した椎間板にさらに浸透するときの椎間板形成性の痛みのため。それらのC-およびAδ繊維は、痛みの応答を伝達する原因となる可能性が高い。椎間板の後縦靭帯と外側の線維輪層には、侵害受容性線維がたくさん含まれています。神経線維および神経終末はまた、軟骨関節軟骨下骨にも発生する。それらは軟骨下骨から関節軟骨に伸びる侵食チャネルで発生します。
(Kiter et al。、2010)による人間の研究では、人間の腸腰靭帯に遊離神経終末とカプセル化神経終末の両方が示されました。研究者(Hirsch et al。、1963)は、棘上靭帯および棘上靭帯に細い神経線維と複雑なカプセル化されていない末端が存在することを示唆しました。
- 内臓
内臓侵害受容器は、末梢皮膚組織の対応するもののように、切断または灼熱の損傷に反応しません。代わりに、それらは病理学的変化に応じて活性化されます。腸間膜の牽引、炎症、胃腸、尿路、胆嚢などの中空の筋肉壁の臓器の膨張、およびそのような中空の臓器を取り巻く筋肉層の強い収縮、化学物質の刺激物、または臓器の虚血などの内臓の痛みを引き起こす刺激ハート。これらの繊維の分布は臓器によって異なります。高閾値受容体は、痛みが唯一の意識的感覚(すなわち、尿管、腎臓、肺、心臓)である器官を排他的に神経支配するが、無害で有害な感覚を提供する器官(例えば、結腸、胃、および膀胱)では比較的少ない。主に低閾値受容体によって神経支配されています。肝臓、肺、腎臓、膵臓などの臓器には受容体がほとんどありませんが、これらの臓器の痛みは主にこれらの臓器のカプセル内の受容体の活性化に起因します。内臓の侵害受容刺激は、局所化するのが難しいびまん性の痛みにつながる。内臓の求心性侵害受容線維は、交感神経および副交感神経に関連して見られます。内臓の大部分は迷走神経によって神経支配されていますが、研究では、この神経が侵害受容性求心性入力を運ぶことができるかどうかは明確に示されていません。しかし、いくつかの研究は、迷走神経求心性神経が高強度の機械的刺激に関する情報を中枢神経系に伝達することを明確に示しています。人間または動物を対象とした多くの研究では、脊髄病変のある被験者は、内臓領域に起因する可能性のある痛みを報告できることが示されています。
- 1.0 1.1 Loeser JD、TreedeRD。 IASPの基本的な痛みの用語の京都議定書。痛み。 2008; 137(3):473–7。 doi:10.1016 / j.pain.2008.04.025。 PMID 18583048
- Basbaum AI、Jessell T.痛みの知覚。 :Kandel ER、Schwartz J、JessellT。の編集者。神経科学の原理。ニューヨーク:アップルトンとランゲ; 2000. p472-491
- 3.0 3.1 3.2 3.3 3.4 3.5メイヤーRA、Ringkamp M、キャンベルJN、Raja SNN。皮膚侵害受容の末梢メカニズム。 In:McMahon SB、Koltzenburg M、編集者。壁とメルザックの痛みの教科書。ロンドン:Elsevier; 2006. p3–34。
- ロイドDPC。猫の同側後肢反射の伝達を制御するニューロンパターン。 J神経生理学。 1943; 6:293–315
- 5.0 5.1 5.2 Schaible HG、SchmidtRF。微細関節求心性ユニットの感覚特性に対する実験的関節炎の影響。神経生理学ジャーナル。 1985; 54:1109-1122
- HäblerHJ、JänigW、KoltzenburgM。急性炎症を起こした膀胱における新しいタイプの無髄化学感受性侵害受容器。エージェントとアクション。 1988; 25:219-221
- タネリアンDL。角膜求心性神経の集団のコリン作動性活性化。実験的脳研究。 1991; 86:414-420
- LaMotte RH、Campbell JNサルにおける温かい侵害受容性C線維求心性神経の反応と人間の熱痛の判断との比較。神経生理学ジャーナル。 1978; 41:509-528
- Treede RD、Meyer RA、Raja SN、Campbell JNサルの皮膚を神経支配する侵害受容性一次求心性神経における2つの異なる熱伝達メカニズムの証拠。生理学ジャーナル。 1995; 483:747-758
- Schepers RJ、Ringkamp M.熱受容器および感熱性求心性神経。神経科学
生物行動学的レビュー。 2010; 34(2):177-184
- Caterina MJ、Schumacher MA、Tominaga M、Rosen TA、Levine JD、Julius D. Nature 1997; 389:816–824
- 13.0 13.1 Ashton IK、Ashton BA、Gibson SJ、Polak JM、Jaffray DC、Eisenstein SM腰痛の形態学的根拠:黄色靭帯ではなく腰椎椎間関節包における神経線維および神経ペプチドの実証。 J Orthop Res。 1992; 10(1):72-78
- Kiter E、Karaboyun T、Tufan AC、AcarK。免疫組織化学的fckLR腸腰靭帯の自由神経終末の実証。脊椎。 2010; 35(4):E101-4。土井:10.1097 / BRS.0b013e3181ae561d。
- Hirsch C、Ingelmark BE、Miller M.lowfckLRbackの痛みの解剖学的根拠。 fckLRヒト腰椎における感覚神経終末infckLR靭帯、被膜および椎間板構造の存在に関する研究。 Acta Orthop Scand。 1963; 33:1–17。
- Moller、Aage(2014-04-22)。痛み、その解剖学、生理学および治療。キンドル版。
Bjur D、Alfredson H、Forsgren S.ヒトのアキレス腱の神経支配パターン:正常および腱の腱の研究。細胞組織解像度。 2005; 320:201-206
extern
