Os nociceptores podem ser ativados por três tipos de estímulos dentro do tecido alvo – temperatura (térmica), mecânica (por exemplo, estiramento / tensão) e química (por exemplo, mudança de pH como resultado de processo inflamatório local). Assim, um estímulo nocivo pode ser categorizado em um desses três grupos.
Os termos nocicepção e dor não devem ser usados como sinônimos, pois um pode ocorrer sem o outro. A dor decorrente da ativação dos nociceptores é chamada de dor nociceptiva. A dor nociceptiva pode ser classificada de acordo com o tecido em que ocorreu a ativação do nociceptor: somática superficial (por exemplo, pele), somática profunda (por exemplo, ligamentos / tendões / ossos / músculos) ou visceral (órgãos internos).
Via da nocicepção
Nem todo nociceptor responde a cada tipo de estímulos nocivos. A aparente falta de resposta a um estímulo nocivo pode resultar de diferentes receptores localizados na membrana do terminal (terminação nervosa livre) ou a intensidade do estímulo é insuficiente. Normalmente, o limiar de estimulação de um nociceptor está abaixo da intensidade de dano ao tecido. Os nociceptores possuem propriedades heterogêneas, respondendo a múltiplas modalidades de estímulo (polimodais). No entanto, a aplicação de estímulos nocivos de uma modalidade pode alterar as propriedades de resposta do nociceptor a outras modalidades. Além disso, a aplicação de um determinado estímulo por um determinado período de tempo pode induzir alterações de longo prazo nas propriedades de resposta do nociceptor. A lesão e a inflamação diminuem o limiar e aumentam a magnitude da resposta a um determinado estímulo, fenômeno conhecido como sensibilização periférica. De particular interesse são os aferentes amielínicos sensíveis ao calor, mas mecanicamente insensíveis, que desenvolvem sensibilidade mecânica apenas no cenário de lesão.
Os nociceptores têm a aparência morfológica de terminações nervosas livres. O termo “terminação nervosa livre” indica que no microscópio óptico nenhuma estrutura receptiva (corpuscular) pode ser reconhecida. No momento, não há diferenças ultraestruturais claras entre as terminações nervosas livres não nociceptivas (por exemplo, mecanorreceptores e termorreceptores sensíveis) e nociceptivos . Funcionalmente, diferentes terminações nervosas livres
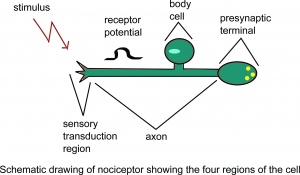
Desenho esquemático do nociceptor mostrando o quatro regiões da célula.
são assumidos como possuindo diferentes conjuntos de moléculas receptoras em sua membrana axonal. As moléculas receptoras que são particularmente importantes para a função de nociceptores musculares são canais iônicos sensíveis ao ácido (ASICs) que se abrem em um baixo pH tecidual, receptores P2X3 que são ativados pela ligação de adenosina trifosfato (ATP) e o receptor potencial transiente subtipo 1 (TRPV1) que é sensível a altas temperaturas, capsaicina química e baixo pH. substância neuropeptídica P tem foi relatado estar presente predominantemente em fibras aferentes nociceptivas. Embora existam vários neurotransmissores no sistema nervoso, os três mais comuns que participam da transmissão nociceptiva são os peptídeos, as purinas e os aminoácidos excitatórios (EAA). Os EAA, particularmente o glutamato, produzem a resposta excitatória inicial no neurônio pós-sináptico de segunda ordem, seguida pela liberação de peptídeos, incluindo a substância P, causando uma despolarização mais prolongada e transmissão nociceptiva sustentada
Nociceptores estão presentes em muitos tecidos do corpo, mas não foram encontrados na cartilagem articular, pleura visceral, parênquima pulmonar, pericárdio, cérebro e tecido do cordão.
Tipos de nociceptores
Várias classes de nociceptores foram descritos. Alguns nociceptores respondem a frio nocivo, calor nocivo e estímulos mecânicos de alto limiar, bem como uma variedade de mediadores químicos. Os nociceptores, embora polimodais, podem ser divididos em duas classes principais com base na resposta a estímulos mecânicos, levando a uma distinção entre aferentes mecanicamente sensíveis (MSA) e aferentes mecanicamente insensíveis (MIA) definidos como aferentes que têm limiares mecânicos muito altos ou não respondem a estímulos mecânicos.
Os nociceptores podem ser classificados pela velocidade de condução de seus axônios ou diâmetro das fibras, este é o grupo III e IV ord Aδ e C, respectivamente.
Aferentes mielinizados do tipo Aδ de diâmetro médio que medeiam a dor aguda, bem localizada, do tipo picada, conhecida como aferente do grupo III. As fibras aferentes Aδ têm diâmetro médio de fibra de 2-5 mm e velocidade condutiva de 5-30 m / s. Os nociceptores Aδ podem ser divididos em dois tipos (parece existir aproximadamente 50% de cada tipo)
- Tipo I Aδ são aferentes mecanicamente sensíveis (MSA) que respondem com uma descarga de adaptação lenta a forte pontuar a pressão.Eles também respondem ao calor e estímulos químicos e têm limiares de calor relativamente altos (> 50C).
- Os nociceptores Aδ do tipo II têm um limiar de calor mais baixo do que as unidades do tipo I, mas têm limiares mecânicos muito altos (chamados de aferentes mecanicamente insensíveis – MIAs). A atividade deste aferente quase certamente medeia a “primeira” resposta aguda de dor ao calor nocivo. Eles foram relatados na articulação do joelho, vísceras e córnea.
Fibras aferentes não mielinizadas do tipo C que transmitem mal localizada, opaca, ardente, chamada de “segunda” ou dor lenta, é conhecida como grupo IV. O diâmetro médio da fibra está abaixo de 2 mm e a velocidade condutiva é de 2 m / s ou menos. As fibras C amielínicas também são heterogêneas. Os aferentes de fibra C podem ser divididos em duas classes com base em sua resposta a estímulos mecânicos. Assim como as fibras aferentes Aδ mielinizadas, a maioria das fibras C são polimodais, ou seja, incluem uma população tanto mecanicamente quanto sensível ao calor (CMHs). A resposta dos CMHs também é fortemente influenciada pela história do estímulo. Tanto fadiga quanto sensibilização são observadas. Uma diminuição na resposta ao calor também é observada após estímulos mecânicos aplicados ao campo receptivo ou estímulos elétricos aplicados ao tronco nervoso. Isso sugere que a fadiga em resposta a uma determinada modalidade de estímulo pode ser induzida por estimulação heteróloga, ou seja, por excitação com um estímulo de uma modalidade diferente. Estes são o tipo predominante de nociceptores de fibra C na pele dos mamíferos. As fibras C mecanicamente insensíveis (C-MIAs) ou não respondem a estímulos mecânicos ou têm um limiar mecânico muito alto. Esses aferentes respondem ao calor e a vários estímulos químicos nocivos (por exemplo, capsaicina, histamina) e são frequentemente considerados quimiorreceptores.
Em resumo, a sensação de dor aguda, bem localizada e imediata é mediada por fibras nervosas mielinizadas de pequeno diâmetro, tipo Aδ. As fibras C medeiam o tipo de dor mal localizada anatomicamente, tem um caráter dolorido e ardente, vem depois da primeira sensação inicial e é difícil estimar sua força.
Canais TRP
Os nociceptores respondem a determinada faixa de temperatura e estímulo mecânico.
A extremidade periférica do axônio contém proteínas encapsuladas chamadas proteínas de transdução (TRP), que podem ser ativadas por um estímulo específico. A superfamília multigênica do potencial de receptor transiente (TRP) codifica proteínas integrais de membrana que funcionam como canais iônicos. A família de canais TRP é de interesse porque vários membros têm sido implicados na transdução do sinal do nociceptor.
Estímulos nocivos de frio e calor nocivos são detectados pelos nociceptores de fibra Aδ e C. A família de canais TRP fornece um grupo de moléculas equipadas para detectar mudanças térmicas. Toda a gama de temperaturas, do frio nocivo ao calor nocivo, parece ser transduzida pela atividade nesses canais iônicos. TRPM8 e TRPV3 / 4 codificam frio e quente, respectivamente, TRPA1 transduz frio nocivo e TRPV1 / 2 detecta calor nocivo. Alguns dos canais TRP termossensíveis também respondem a estímulos químicos e mecânicos.
Por exemplo, TRPV1 é essencial para a transdução de efeitos nociceptivos por efeitos inflamatórios e hipotérmicos de compostos vaniloides e contribui para a nocicepção térmica aguda e hiperalgesia térmica após lesão do tecido. A corrente TRPV1 é potencializada pela bradicinina e fator de crescimento nervoso por meio de vários mecanismos possíveis e também é ativada por prótons e capsaicina, o composto ‘‘ quente ’’ da pimenta malagueta. Em contraste com a hiperalgesia após estímulos nocivos intensos, a exposição prolongada à capsaicina pode resultar em dessensibilização subsequente.
Embora a descoberta de canais TRP termossensíveis tenha melhorado muito nossa compreensão dos mecanismos de transdução de estímulos térmicos, descobertas em animais com deleções genéticas seletivas claramente indicam que mecanismos de transdução múltiplos e ainda desconhecidos são acionados por estímulos térmicos.
Mediadores químicos
A lesão resulta na liberação local de numerosos produtos químicos de células não neuronais (por exemplo, fibroblastos, mastócitos, neutrófilos, monócitos e plaquetas), bem como dos terminais sensoriais de fibras aferentes primárias que medeiam ou facilitam o processo inflamatório. Os mediadores inflamatórios incluem prostaglandinas, leucotrienos, bradicinina, serotonina, histamina, SP, tromboxanos, fator ativador de plaquetas, purinas como adenosina e ATP, prótons e radicais livres. Citocinas, como interleucinas e fator de necrose tumoral, e neurotrofinas, especialmente NGF, também são geradas durante a inflamação.É importante notar que a maioria desses produtos químicos (principalmente substâncias como bradicinina e prostaglandina E2) geralmente não ativa os nociceptores diretamente, mas melhora a sensação de dor em resposta a estímulos naturais e outros produtos químicos endógenos, aumentando a frequência de ação potencial disparo.
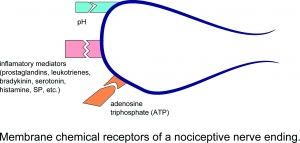
Receptores químicos da membrana de uma terminação nervosa nociceptiva.
A ativação de nociceptores não apenas transmite mensagens aferentes ao corno dorsal da medula espinhal, mas também inicia o processo de inflamação neurogênica. A inflamação neurogênica causa uma liberação de neurotransmissores, notadamente a substância P e o peptídeo relacionado ao gene da calcitonina (CGRP), que leva à vasodilatação severa, bem como ao vazamento de proteínas e fluido plasmático das vênulas pós-capilares.
Dois produtos químicos são de particular interesse:
- Trifosfato de adenosina (ATP)
ATP é a molécula carregadora de energia em todas as células do corpo. É liberado de todos os tecidos durante o trauma e outras alterações patológicas associadas à morte celular. Por esse motivo, o ATP tem sido considerado uma substância sinalizadora geral para trauma e dor em tecidos. Em estudos microneurográficos humanos, a injeção de ATP ativou 60% das fibras C-nociceptivas mecano-responsivas e mecanosensíveis, sem sensibilizar essas fibras a estímulos mecânicos ou térmicos. O ATP ativa os receptores purinérgicos P2X3 nos nociceptores, causando uma descarga. O ATP é particularmente importante para dores musculares porque está presente nas células musculares em alta concentração.
- Alteração de prótons no pH do tecido
Os canais iônicos com detecção de ácido (ASICs) constituem uma família de moléculas receptoras que são sensíveis a uma queda no pH e abrem em vários valores de pH. As proteínas do canal já reagem a mudanças de pH muito pequenas. Esta família de receptores (por exemplo ASIC1 e ASIC3) é particularmente importante para a dor muscular porque quase todas as mudanças patológicas no músculo são acompanhadas por uma queda no pH do tecido, por exemplo, exercício exaustivo, isquemia e inflamação.
Localização dos nociceptores
Os corpos celulares dos nociceptores estão localizados nos gânglios da raiz dorsal (DRG) para a periferia e no gânglio trigêmeo para a face. Seus axônios se estendem até o sistema nervoso periférico e terminam em ramos, criando campos receptivos.
- Pele
As terminações nervosas livres que terminam na pele são o mecanismo para sinalizar mudanças mecânicas, térmicas e químicas locais. A grande maioria das terminações nervosas livres na pele são chamadas de nociceptores polimodais porque contêm vários receptores e, portanto, respondem a várias combinações dos estímulos mencionados acima. As unidades de mecanorreceptores de alto limiar Aδ do tipo I são densamente distribuídas na pele peluda e glabra.
- Músculos
Moléculas receptoras que são particularmente importantes para o A função dos nociceptores musculares são canais iônicos sensíveis ao ácido (ASICs) que se abrem em um baixo pH do tecido, receptores P2X3 que são ativados pela ligação de trifosfato de adenosina (ATP) e o receptor potencial transiente subtipo 1 (TRPV1) que é sensível a alto temperaturas e baixo pH.
No músculo esquelético, as terminações nervosas livres parecem estar distribuídas de maneira bastante uniforme. Nenhuma diferença entre as porções proximal e distal do músculo gastrocnêmio-sóleo de rato foi encontrada. No entanto, no mesmo estudo, a densidade da fibra nervosa no peritendíneo do tendão do calcâneo de rato foi várias vezes maior do que no músculo GS. Em contraste, os feixes de fibra de colágeno do tecido do tendão propriamente dito eram quase livres de terminações nervosas livres.
- Tendões
Inervação dos tendões de Aquiles humanos é fornecido pelos nervos dos músculos circundantes e por pequenos fascículos dos nervos cutâneos, mas envolve todas as terminações nervosas. As terminações nervosas livres são representadas dentro dos tendões, mas principalmente no tecido peritendinoso, são receptores de dor. O número e a localização de todas as fibras nervosas e terminações nervosas variam de acordo com a função do tendão, sendo mais representados nos tendões menores envolvidos nos movimentos finos.
- Articulação
Os nociceptores nas articulações estão localizados dentro da cápsula articular, ligamentos e tendões proximais, osso, periósteo, almofada de gordura articular e ao redor dos vasos sanguíneos, mas não na cartilagem articular. Os aferentes nociceptivos de alto limiar terminam principalmente na sinóvia e no periósteo e normalmente respondem apenas ao movimento da articulação além dos limites de trabalho. Após o dano articular, dois fatores se combinam para alterar a sensibilidade mecânica dos nociceptores articulares.Primeiro, as mudanças físicas (derrame articular e edema tecidual) alteram as forças induzidas por movimento e repouso exercidas sobre os tecidos articulares e, segundo, mediadores inflamatórios liberados dentro do tecido danificado sensibilizam os aferentes nociceptivos articulares ligando-se a receptores nas terminações nervosas. Muitos nociceptores da articulação respondem a movimentos inócuos, mas são cada vez mais ativados quando os movimentos excedem a faixa de trabalho fisiológica, enquanto outros nociceptores são ativos exclusivamente durante movimentos nocivos. O terceiro grupo dos chamados nociceptores silenciosos são normalmente inativos e respondem apenas em circunstâncias patológicas, como inflamação.
Foi demonstrado que a cápsula articular da faceta lombar é ricamente inervada por nociceptores e fibras proprioceptivas. Em um estado normal, os nociceptores, como aqueles vistos na cápsula da articulação facetária, têm um alto limiar e não se espera que descarreguem, a menos que as cargas sejam suprafisiológicas. No entanto, na presença de inflamação patológica da articulação, os mediadores químicos da sinovite podem sensibilizar esses nociceptores e os níveis suprafisiológicos de estresse podem não ser mais necessários para estimular a dor. Esses mediadores inflamatórios (substância P, bradicinina, fosfolipase A2) foram detectados na cápsula da articulação facetária.
Os nociceptores nos discos intervertebrais são normalmente limitados ao terço externo do anel, podendo ser o substrato para dor discogênica quando eles são expandidos sobre a área anular maior e penetram ainda mais no disco degenerado ao longo da vasculatura e fissuras. Essas fibras C- e A δ são provavelmente responsáveis por transmitir as respostas à dor. O ligamento longitudinal posterior e as camadas externas do anel fibroso do disco intervertebral contêm muitas fibras nociceptivas. Fibras nervosas e terminações nervosas também ocorrem no osso subcondral das articulações zigapofisiárias. Eles ocorrem em canais de erosão que se estendem do osso subcondral à cartilagem articular.
Um estudo humano por (Kiter et al., 2010) mostrou terminações nervosas livres e encapsuladas no ligamento iliolombar humano. Studie por (Hirsch et al., 1963) sugeriu a presença de fibras nervosas finas e terminações não encapsuladas complexas nos ligamentos supraespinhoso e intraespinhoso.
- Viscera
Os nociceptores viscerais não respondem a lesões por corte ou queimadura como seus homólogos no tecido cutâneo periférico. Em vez disso, eles são ativados em resposta à mudança patológica. Estímulos que produzem dor nas vísceras, incluindo tração no mesentério, inflamação, distensão de órgãos ocos de paredes musculares, como gastrointestinal, trato urinário, vesícula biliar e fortes contrações das camadas musculares ao redor de tais órgãos ocos, irritantes químicos ou isquemia em órgãos como o coração. A distribuição dessas fibras varia entre os órgãos. Os receptores de alto limiar inervam exclusivamente os órgãos dos quais a dor é a única sensação consciente (ou seja, ureter, rim, pulmões, coração), mas são relativamente poucos em órgãos que fornecem sensações inócuas e nocivas (por exemplo, cólon, estômago e bexiga), inervado principalmente por receptores de baixo limiar. Órgãos, como fígado, pulmões, rins e pâncreas, têm poucos receptores, mas a dor desses órgãos provém principalmente da ativação de receptores nas cápsulas desses órgãos. A estimulação nociceptiva das vísceras leva a uma dor difusa de difícil localização. As fibras nociceptivas aferentes nas vísceras são encontradas em associação com os nervos simpático e parassimpático. A maioria dos órgãos viscerais são inervados pelo nervo vagal, mas os estudos não mostram claramente se esse nervo é capaz de transportar estímulos aferentes nociceptivos ou não. No entanto, alguns estudos demonstram claramente que as aferências vagais transmitem informações sobre estímulos mecânicos de alta intensidade para o sistema nervoso central. Vários estudos envolvendo humanos ou animais mostraram que indivíduos com lesão espinhal são capazes de relatar dor provavelmente originada na área dos órgãos viscerais.
- 1,0 1,1 Loeser JD, Treede RD. O protocolo de Kyoto da Terminologia Básica de Dor da IASP. Dor. 2008; 137 (3): 473–7. doi: 10.1016 / j.pain.2008.04.025. PMID 18583048
- Basbaum AI, Jessell T. The Perception of Pain. In: Kandel ER, Schwartz J, Jessell T. editores. Principles of Neuroscience. Nova York: Appleton e Lange; 2000. p472-491
- 3,0 3,1 3,2 3,3 3,4 3,5 Meyer RA, Ringkamp M, Campbell JN, Raja SN. Mecanismos periféricos de nocicepção cutânea. In: McMahon SB, Koltzenburg M, editores. Wall and Melzack’s Textbook of Pain. Londres: Elsevier; 2006. p3–34.
- Lloyd DPC. Padrões de neurônios que controlam a transmissão dos reflexos dos membros posteriores ipsilaterais em gatos. J Neurophysiol. 1943; 6: 293–315
- 5,0 5,1 5,2 Schaible HG, Schmidt RF. Efeitos de uma artrite experimental nas propriedades sensoriais de unidades aferentes articulares finas. Journal of Neurophysiology. 1985; 54: 1109-1122
- Häbler HJ, Jänig W, Koltzenburg M.Novo tipo de nociceptor quimiossensível não mielinizado na bexiga urinária com inflamação aguda. Agentes e ações. 1988; 25: 219-221
- Tanelian DL. Ativação colinérgica de uma população de nervos aferentes da córnea. Experimental Brain Research. 1991; 86: 414-420
- LaMotte RH, Campbell JN. Comparação das respostas de aferentes de fibra C quentes e nociceptivos em macacos com julgamentos humanos de dor térmica. Journal of Neurophysiology. 1978; 41: 509-528
- Treede RD, Meyer RA, Raja SN, Campbell JN. Evidência de dois mecanismos diferentes de transdução de calor em aferentes primários nociceptivos que inervam a pele de macaco. Journal of Physiology. 1995; 483: 747-758
- Schepers RJ, Ringkamp M. Thermoreceptors and thermosensitive aferents. Neuroscience & Avaliações biocomportamentais. 2010; 34 (2): 177-184
- Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. O receptor de capsaicina: um canal de íon ativado por calor na via da dor. Nature 1997; 389: 816–824
- Bjur D, Alfredson H, Forsgren S. O padrão de inervação do tendão de Aquiles humano: estudos do tendão normal e da tendinose com marcadores para inervação geral e sensorial. Cell Tissue Res. 2005; 320: 201-206
- 13,0 13,1 Ashton IK, Ashton BA, Gibson SJ, Polak JM, Jaffray DC, Eisenstein SM. Base morfológica para dor nas costas: a demonstração de fibras nervosas e neuropeptídeos na cápsula articular da faceta lombar, mas não no ligamento fl avum. J Orthop Res. 1992; 10 (1): 72-78
- Kiter E, Karaboyun T, Tufan AC, Acar K. ImmunohistochemicalfckLRdemonstration of freeervo finalings in iliolumbar ligament. Coluna vertebral. 2010; 35 (4): E101-4. doi: 10.1097 / BRS.0b013e3181ae561d.
- Hirsch C, Ingelmark BE, Miller M. A base anatômica para dor nas costas baixas. Estudos sobre a presença de terminações nervosas sensoriais nas estruturas do disco ligamentar, capsular e intervertebral na coluna lombar humana. Acta Orthop Scand. 1963; 33: 1–17.
- Moller, Aage (22/04/2014). Dor, sua anatomia, fisiologia e tratamento. Edição Kindle.
