Newsflash
Newsflash avbryter favoritt-TV-programmet ditt. «Det har vært en hold-up i First National Bank. Den mistenkte flyktet i en bil og antas å være et sted i sentrumsdistriktet. Alle blir bedt om å være på vakt.» Raneren kan bare lokaliseres innenfor et bestemt område — politiet har ikke en nøyaktig plassering, bare en generell ide om hvor tyven befinner seg.
I 1926, Den østerrikske fysikeren Erwin Schrödinger (1887–1961) brukte elektronens bølgepartikkedualitet til å utvikle og løse en kompleks matematisk ligning som nøyaktig beskrev oppførselen til elektronet i et hydrogenatom. Den kvantemekaniske modellen til atomet kommer fra løsningen. til Schrödingers ligning. Kvantisering av elektronenergier er et krav for å løse ligningen. Dette er i motsetning til Bohr-modellen, hvor kvantisering ganske enkelt ble antatt uten matematisk grunnlag.
Husk at i Bohr-modellen, den nøyaktige banen til elektronet var begrenset til veldig veldefinerte sirkulære baner rundt kjernen. Den kvantemekaniske modellen er en radikal avvik fra det. Løsninger til Schrödinger-bølgeligning, kalt bølgefunksjoner, gir bare sannsynligheten for å finne et elektron på et gitt punkt rundt kjernen. Elektroner beveger seg ikke rundt kjernen i enkle sirkulære baner.
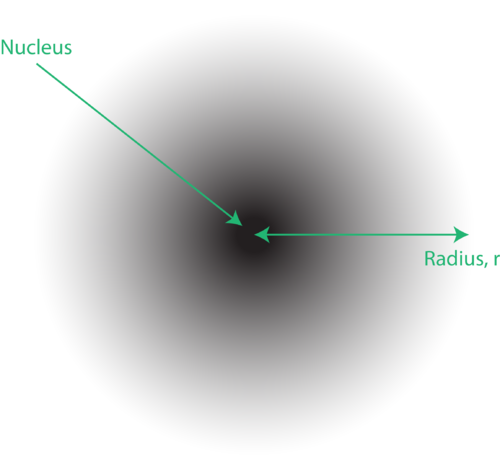
Figur 1. En elektronsky: den mørkere regionen nærmere kjernen indikerer stor sannsynlighet for å finne elektronet, mens den lysere regionen lenger fra kjernen indikerer lavere sannsynlighet for å finne elektronet.
Plasseringen av elektronene i den kvantemekaniske modellen til atomet blir ofte referert til som en elektronsky. Elektronskyen kan tenkes på følgende måte: Tenk deg å plassere et kvadratisk stykke papir på gulvet med en prikk i sirkelen som representerer kjernen. Ta nå en markør og slipp den på papiret gjentatte ganger, og gjør små merker på hvert punkt markøren treffer. Hvis du slipper markøren mange, mange ganger, vil det generelle mønsteret for prikker være omtrent sirkulært. Hvis du sikter mot sentrum rimelig bra, vil det være flere prikker nær kjernen og gradvis færre prikker når du beveger deg bort fra den. Hver prikk representerer et sted der elektronet kan være til enhver tid. På grunn av usikkerhetsprinsippet er det ingen måte å vite nøyaktig hvor elektronet er. En elektronsky har variabel tetthet: en høy tetthet der elektronet er mest sannsynlig å være og en lav tetthet der elektronet er minst sannsynlig å være (figur 1).
For å spesifikt definere formen til skyen, er det vanlig å referere til området i rommet der det er en 90% sannsynlighet for å finne elektronet. Dette kalles en orbital, det tredimensjonale rommet i rommet som indikerer hvor det er stor sannsynlighet for å finne et elektron.
Sammendrag
- Schrödinger-bølgen ligning erstattet Bohr-ideene om elektronplassering med en usikkerhetsfaktor.
- Plasseringen av elektronet kan bare gis som en sannsynlighet for at elektronet er et sted i et bestemt område.
Øv
Bruk lenken nedenfor for å svare på følgende spørsmål:
http://science.howstuffworks.com/atom8.htm
- Hva var ett problem med Bohr-modellen av atomet?
- Hva viste Heisenberg om elektroner?
- Hva utledet Schrödinger?
Gjennomgang
- Hva krever det kvantemekaniske synet på atomet?
- Hva er en bølgefunksjon?
- Hva foreslår en elektronsky med høy tetthet?
Ordliste
- elektronsky: Plasseringen til elektroner i kvantemekanisk modell av atomet.
- orbital: Det tredimensjonale området av rommet som indikerer hvor det er stor sannsynlighet for å finne et elektron.
- kvantemekanisk modell: En modell av atomet som kommer fra Schrödinger-bølgeligningen og håndterer sannsynligheter.
- bølgefunksjon: Gi bare sannsynligheten for å finne et elektron på et gitt punkt rundt kjernen.
