Hvorfor sier folk at vann er nødvendig for livet? Hvorfor har vi aldri funnet noen levende organismer som kan blomstre i et helt tørt miljø? Hvordan kan det være at noe luktfritt, fargeløst, smakløst og relativt ureaktivt utgjør 60% av kroppsmassen vår? Hvorfor kunne ikke en annen væske brukes? Hvorfor vann?
Vann har flere egenskaper som gjør det unikt blant forbindelser og gjør det mulig for alle former for kjent liv å fungere.
Det er det eneste naturlige stoffet som finnes i alle tre fysiske tilstander ved temperaturene som naturlig forekommer på jorden.
Dette betyr at vi ser vann som en væske, i elver og hav, et fast stoff, som snø og is, og som en gass, som skyer eller damp. Hvis dette ikke var tilfelle, ville vannsyklusen være helt annerledes (hva om vannet ikke fordampet i solen?); Snø og is eksisterte kanskje ikke (og tusenvis av arter ville nå være hjemløse) og været ville være veldig annerledes ( ville det fortsatt regne?). Kan du tenke deg noe annet som ville være annerledes? Tror du at vi fortsatt kunne leve hvis vann bare var en væske ved temperaturene som forekommer naturlig på jorden? Hva med bare et gass / fast stoff?
Is er mindre tett enn vann
Dette betyr bare at is flyter på vann og at innsjøer fryser fra topp til bunn. Dette er helt klart viktig for dyr som lever på is, da deres habitater ville bli kraftig redusert eller ikke eksisterer i det hele tatt hvis isen sank. På samme måte vil fisk og annet damliv påvirkes hvis innsjøer og dammer frøs ned fra bunnen og oppover – laget med frossent vann på toppen av dammen gir en viss isolasjon og forhindrer at resten av vannet blir kaldt Det gjør dette ved å lage en barriere mellom kulden luft og vannet under. Dette betyr at store vannmasser ikke blir kaldere dypere ned så fort de kunne hvis isen sank og hjelper dyrelivet å overleve i dammer om vinteren. Faktisk blir vannet tettere når det blir avkjølt til det når $ 4 ^ \ circ $ C (som du kan se på grafen), hvoretter den blir mindre tett igjen. De fleste stoffer blir gradvis tettere etter hvert som de avkjøles. Grafen nedenfor viser hvordan tettheten av vann endres med temperaturen.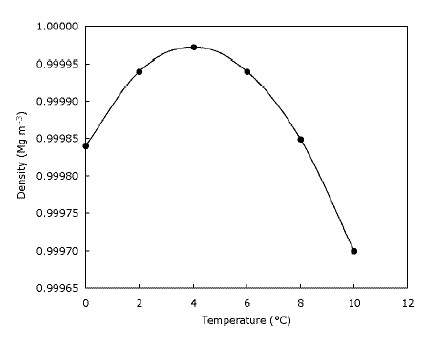
Vann har et veldig høyt smelte- og kokepunkt sammenlignet med andre lignende molekyler. Dette er det som betyr at det blir sett på som et fast stoff, en væske og en gass på jorden. Hvis vann ikke var et væske ved de fleste temperaturene vi ser på jorden, ville havet være is, det ville ikke være regn, ingenting for planter å samle og dyr å drikke. Selv cellene våre er fylt med flytende vann, noe som heller ikke ville være mulig. br> Det kalles det «universelle løsningsmidlet» fordi det er i stand til å oppløse så mange stoffer.
Vannet i kroppene våre i Det er for det meste inneholdt i cellene våre, hvor det gir dem en klar form, i tillegg til at de har milliarder nyttige molekyler oppløst i seg. Cellene våre må fylles med vann for å fungere ordentlig fordi enzymene i dem bare fungerer i løsning. Vann er også virkemåten for transport i kroppene våre. «Blod er for det meste vann og har hormoner og gasser oppløst init samt toksiner som urea, som fjernes fra kroppen med enda mer vann. Transport i vann skjer også på en mye mindre skala: når noe er oppløst, kan det bevege seg i løsningsmidlet. For eksempel, hvis et enzym trenger kalsiumioner for å bli aktivert og begynner å virke, vil det møte disse når de beveger seg rundt i løsningen inne i en celle. Jo høyere konsentrasjon jo mer sannsynlig vil enzymet møte et ion raskere. Du har kanskje også lært om diffusjon og osmose, som er nøkkelbegreper for å forstå hvordan celler fungerer og stole på tilstedeværelsen av vann. Vann har en høy spesifikk varmekapasitet.
Selv om denne ideen høres litt skremmende ut, er den faktisk veldig enkel – alt det betyr er at det tar mye energi å gjøre vannet litt varmere. Det er derfor på en varm dag sanden på en strand kan være for varmt til å gå på, men havet føles fortsatt kult; energien fra solen er nok til å varme sanden mye, men vannet bare litt. Dette har noen veldig viktige implikasjoner, spesielt for organismer som lever i vann. Sjøer, innsjøer og elver holder en mye mer konstant temperatur enn luft, noe som betyr at dyr kan leve i vann hele året uten å måtte tilpasse seg store temperaturendringer (Hva tror du vil skje hvis vannet avkjøles lettere? Hvilke problemer kan dette utgjør organismer som bor i en liten dam?). Dette betyr også at kroppstemperaturen vår er ganske vanskelig å endre seg raskt og dermed gjør hjernens jobb med å opprettholde en konstant kroppstemperatur mye lettere (Hva kan skje hvis kroppstemperaturen vår endres raskt og enkelt?).
Overflatespenning
Du har kanskje lagt merke til at hvis du legger en nål på overflaten av en bolle med vann, flyter den, men hvis du kaster den i den, synker den.Dette er fordi nålen er tettere enn vann så ønsker å synke, men holdes oppe av vanns overflatespenning. Overflatespenning er en egenskap som betyr at vannoverflaten ikke vil bryte – den er «klebrig». Du kan også se dette når du fyller en kopp til randen, da vannoverflaten holder seg sammen og motstår søl. Den høye overflatespenningen til vann er grunnen til at noen fluer kan lande på overflaten uten å synke. Dette konseptet er også veldig nært knyttet til et annet, ideen om kapillærvirkning.
Kapillærvirkning
På samme måte som overflatespenning, dreier dette seg om ideen om at vannmolekyler «henger sammen». Hvis du legger et veldig fint rør i et begerglass med vann, vil du se at noe av vannet beveger seg en kort vei oppover røret; dette kalles kapillærvirkning og er forårsaket av at vannet klamrer seg til sidene av røret og andre vannmolekyler, og trekker dem opp med røret. Til slutt er vekten av vannet som trekkes for stor til å bli støttet, og vannet slutter å bevege seg, etter å ha nådd en likevekt. Det samme prinsippet lar planter trekke vann opp fra bakken; når vannmolekyler beveger seg oppover stammen, holder flere vannmolekyler seg til dem og mer holder seg til dem og så videre til en søyle med vann blir transportert i xylemet (for å finne ut mer om dette, slå opp «transpirasjon»).
Men hvorfor?
Alle disse egenskapene til vann er kritiske for livet slik vi kjenner det, men hvorfor har vann dem? Gjør ingen andre stoffer også disse tingene? Hva er det med vann som gjør det annerledes? For å forstå svarene på disse spørsmålene må du studere vannets molekylære struktur. Den kjemiske formelen for vann er H2O, noe som betyr at den inneholder to hydrogenatomer kovalent bundet til et oksygenatom, slik: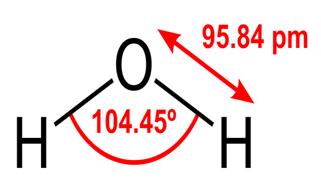
95.84pm viser lengden på binding mellom oksygen og hydrogen; en pm er en forkortelse for en pikometre, som er en billiontedel av en meter. Vinkelen som vises er den spisse vinkelen mellom de to hydrogenkjernene (har du noen ideer om hvorfor det ikke er $ 180 ^ \ circ $? Hvorfor skal det være $ 180 ^ \ circ $?) Dette diagrammet representerer bindingene som linjer, som får det til å se ut som om de er de samme på evig punkt? Dette er ikke tilfelle. Fordi oksygen er mer elektronegativ enn hydrogen, tiltrekker det seg elektronene i OH-bindingen mot seg selv. Hvis tykkelsen på linjen representerer elektrontetthet (mengden tid elektroner bruke den delen av bindingen), ser OH-bindingen faktisk mer slik ut:
BILDE som viser polarisering av bindingen
Som du kan se, bruker elektronene mesteparten av tiden nærmere oksygenkjernen. Dette betyr at oksygen er litt negativt ladet og at hydrogenene er litt positivt ladet. Dette kalles polaritet og er nøkkelkonseptet bak egenskapene til vann
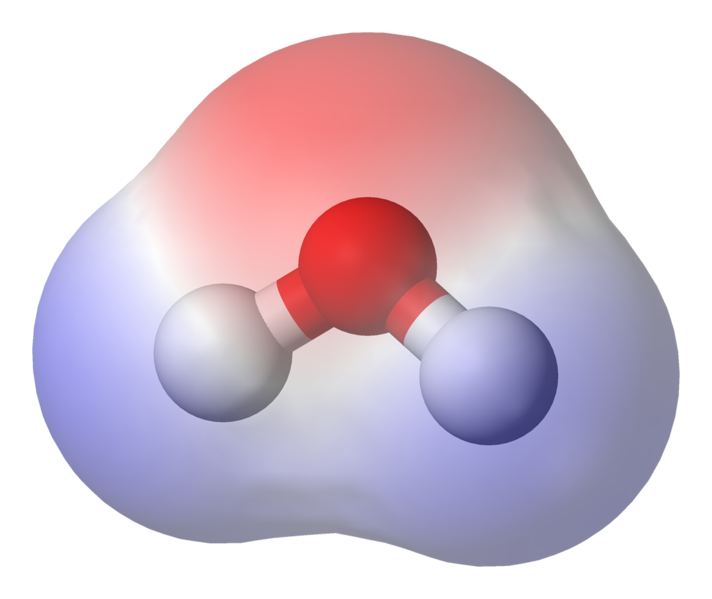
Dette betyr at svake ioniske interaksjoner kan forekomme mellom n nærliggende vannmolekyler som det litt positive hydrogenet fra ett molekyl tiltrekkes av det litt negative oksygenet på et annet. Disse kalles hydrogenbindinger.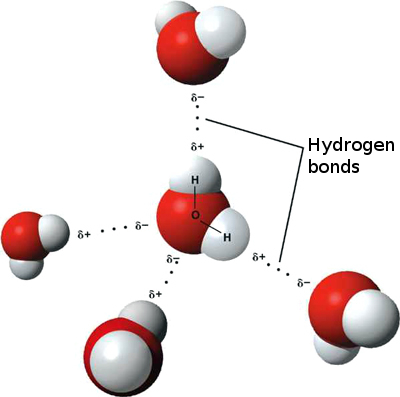
Dette er hvorfor vann «fester» seg til seg selv, noe som gir det høy overflatespenning og muligheten til å bevege seg ved kapillærvirkning. > Det kreves mye energi for å bryte ned hydrogenbindinger, det er derfor smelte- og kokepunktene til vann er høye og hvorfor det har høy spesifikk varmekapasitet
Et stoff vil oppløses i vann hvis det er polært eller ionisk. Dette skyldes at den oppløses ved å danne hydrogenbindinger med vannet. Olje er ikke polar, og det er derfor den ikke vil oppløses. Salt, NaCl, oppløses fordi det er ionisk. Kan du tenke deg noen andre stoffer som er oppløselige i vann? Hvordan danner de hydrogenbindinger med det? Kan du tegne et lignende bilde som det nedenfor som viser hvorfor glukose er løselig? Er det mer eller mindre løselig i vann enn salt? Hvorfor tror du dette er?
Et diagram over hva som skjer med NaCl i løsning:
