Læringsmål
- Å skrive kjemiske ligninger for vann som fungerer som en syre og som en base.
Vann (H2O) er en interessant forbindelse i mange henseender. Her vil vi vurdere dens evne til å oppføre seg som en syre eller en base.
Under noen omstendigheter vil et vannmolekyl akseptere et proton og dermed fungere som en Brønsted-Lowry-base. Vi så et eksempel i oppløsningen av HCl i H2O:
\
Under andre omstendigheter kan et vannmolekyl donere en proton og dermed fungere som en Brønsted-Lowry-syre. For eksempel, i nærvær av amidionet (se eksempel 4 i avsnitt 10.2), donerer et vannmolekyl en proton, noe som gjør ammoniakk som et produkt:
\
I dette tilfellet , NH2− er en Brønsted-Lowry-base (protonakseptoren).
Så, avhengig av omstendighetene, kan H2O fungere som en Brønsted-Lowry-syre eller en Brønsted-Lowry-base. Vann er ikke det eneste stoffet som kan reagere som en syre i noen tilfeller eller en base i andre, men det er absolutt det vanligste eksemplet — og det viktigste. Et stoff som enten kan donere eller akseptere en proton, avhengig av omstendighetene, kalles en amfiprotisk forbindelse.
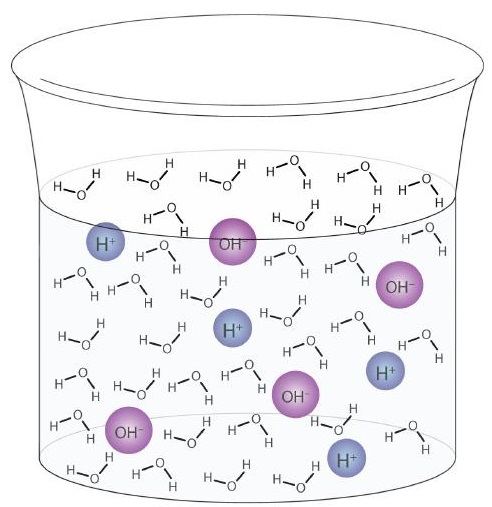
Et vannmolekyl kan fungere som en syre eller en base selv i en prøve av rent vann. Omtrent 6 av hver 100 millioner (6 av 108) vannmolekyler gjennomgår følgende reaksjon:
\
Denne prosessen kalles autoionisering av vann (Figur \ (\ PageIndex {1} \)) og forekommer i hver vannprøve, enten det er rent eller en del av en løsning. Autoionisering forekommer til en viss grad i en hvilken som helst amfiprotisk væske. (Til sammenligning gjennomgår også flytende ammoniakk autoionisering, men bare omtrent 1 molekyl av en million milliarder (1 av 1015) reagerer med et annet ammoniakkmolekyl.)
Concept Review Exercises
- Forklar hvordan vann kan fungere som en syre.
- Forklar hvordan vann kan fungere som en base.
Svar
- Under de rette forholdene kan H2O donere et proton, noe som gjør det til en Brønsted-Lowry-syre.
- Under de rette forholdene kan H2O akseptere et proton, noe som gjør det til et Brønsted-Lowry base.
Key Takeaway
- Vannmolekyler kan fungere som både en syre og en base, avhengig av vilkårene.
