Eset: 73 éves férfi hipertóniában, koszorúér-betegségben és korábbi szívizomban szenvedő kórtörténetben az infarktus (MI) fáradtsággal, légszomjjal, csökkent vizeletmennyiséggel és boka duzzanattal jelentkezik a sürgősségi osztályon. Érkezéskor létfontosságú tünetei közé tartozik a 87/58 Hgmm, a HR 102, az RR 24, a szobahőmérséklet 86% -os telítettsége és a 98,2 F hőmérséklet, és a fülhallgatón ropogások vannak. Hogyan kezelné ezt a beteget?
Mi az a kardiogén sokk?
Bár a definíciók eltérnek, a kardiogén sokk (CS) egy klinikai diagnózis, amelyet széles körben az alacsony szívteljesítmény állapotaként definiálnak a nem megfelelő végszervi perfúzió, vagy a szövet károsodása miatt másodlagos szöveti hipoperfúzió. 1 A SHOCK-vizsgálatból származó gyakran használt kritériumok a hipotenzióból (SBP < 90mmHg vagy > 90mmHg szupportív ellátással), a végső szervi hipoperfúzió és szívindex (CI) < 2,2 L / perc / m2 vagy pulmonalis kapilláris éknyomás ≥ 15 Hgmm 2,3 Bár ez a meghatározás hasznos a klinikai vizsgálatok felvételi kritériumainak egységesítésére , kevésbé értékes a CS diagnosztizálására a sürgősségi osztályon (ED). Az elfoglalt ED-ben bekövetkező váltáskor a CS diagnosztizálása kihívást jelenthet a sokféle prezentáció, az átfedés más sokkállapotokkal (pl. Szepszis), a rosszul ismert kórélettan, a komplex és multifaktoriális okok és a változatos hemodinamikai paraméterek miatt.4 Invazív szívteljesítmény hiányában (CO) és PCWP értékekre, a CS-re következtetni lehet a megnövekedett töltőnyomás (pl. Tüdőgörgés vagy megnövekedett JVP), a hipoperfúzió klinikai tüneteinek, valamint a szívelégtelenségre utaló kórelőzmények és visszhangok felhasználásával. A központi idegrendszeri halálozás magas (~ 25-70%), de a korai felismerés és a beavatkozás javítja a túlélést. Ez az áttekintés a felismerésre és tippekre összpontosít, hogyan lehet kihagyni a CS diagnózisát a fizikai vizsga, a laboratóriumok, az ágy melletti ultrahang és a képalkotás útján.
Melyek a kardiogén sokk okai?
A legtöbb CS-vizsgálat a bal kamrát érintő myocardialis infarctus (MI) miatt másodlagos CS-ben szenvedő betegekre összpontosít. Bár a szívinfarktus az elsődleges oka a CS-nek (~ 70%), figyelembe kell venni a kamrai diszfunkció bármely okát és a csökkent CO- vagy szívindexet (CO / testfelület) mint lehetséges okot.6 Ez magában foglalja, de nem kizárólagosan, a jobb szívelégtelenség, a szívizomgyulladás, a takotsubo-kardiomiopátia, a hipertrófiás kardiomiopátia vagy a szívbillentyű betegség noniszkémiás okai (1. táblázat). Annak érdekében, hogy a dolgok nagyobb kihívásokkal járjanak, a CS inkább folytonosság, mint statikus állapot, a súlyosbodó szívelégtelenségtől kezdve a refrakter sokkig, visszafordíthatatlan végszervi károsodással (1. ábra). A CS még változékonyabbá válik a másodlagos sértések, például aritmiák, progresszív ischaemia és acidózis előfordulásával.3 Meg kell jegyezni, hogy az esetek 2/3-ban a CS nincs jelen a felvételkor, de később a kórházi kezeléstől számított 48 órán belül kialakul A sokk folytonossága lefelé halad.7 Fontos, hogy gyakran átértékeljük a betegek létfontosságú jeleit, tüneteit, fizikális vizsgálatát és az ágy melletti visszhangját.

1. táblázat: A CS okai, adaptálva: Parrillo & Dellinger (2013). A CS-esetek 8% -át akut MI okozza. 6 Az akut MI mellékhatásai százalékok a SHOCK próba-nyilvántartás eredményeiből származnak. 9.10
1. ábra: A CS folytatása, Bellumkonda et al. . (2018) .3 Ez a spektrum eltérhet másodlagos sértésekkel (pl. Új aritmiák).
Halandóság kardiogén sokkban
Bár a CS miatt másodlagos halálozás továbbra is magas, 4 korai felismerés és beavatkozás javítja a túlélést.5 A SHOCK próba nyilvántartást tartalmazó adatok felhasználásával 1217 beteg 30 napos kórházi mortalitása 57% volt, akiknél a bal kamra (LV) vagy a jobb kamra (RV) kudarcát diagnosztizálták akut MI miatt. . Ha több kockázati tényezőt is figyelembe vesz, különösen a bejutás sokkját, életkorát, korábbi koszorúér bypass ojtását (CABG), nem alacsonyabb szintű MI-t, kreatinin > 1,9 mg / dl, csökkent SBP-t, anoxiás agysérülés és a vég-szerv hipoperfúzió klinikai bizonyítéka alapján a betegek 12% és 88% közötti mortalitással oszthatók fel .11 A GRACE vizsgálatban a CS gyengén, de szignifikánsan csökkent 1999 és 2006 között, valószínűleg a perkután koszorúér-beavatkozás (PCI), a korai beavatkozás fontos formája MI-ben szenvedő betegeknél, CS által bonyolítva.12 Még akkor is, ha a betegeket kockázati tényezők alapján rétegezték, a PCI és a CABG mind az alacsony, mind a magas kockázatú betegek számára előnyös volt.11 A korai diagnózis és a megfelelő kezelés továbbra is fennáll, különösen a szívizom ischaemia esetén, amely fontos módosítható hozzájárulás a CS-ben szenvedő betegek kimeneteléhez.
Ezenkívül minél hosszabb a CS előrehaladása, annál valószínűbb, hogy maladaptív gyulladás lesz a szívaktivitást gátló citokinek, például a TNF-alfa és az IL-6 növekedésének másodlagos válasza. 4,13 Szintén növekszik a vazopresszin és az angiotenzin II, ami növeli az utóterhelést, rontja a CO-t, növeli a víz- és só-visszatartást, ezáltal tüdőödémát okozva. A nitrogén-monoxid (NO) szintén megnövekszik az NO-szintáz aktiválása révén, ami értágulathoz és szívizom depresszióhoz vezet. Mindezek az alacsony CO és a szívizom ischaemiára adott maladaptív válaszok súlyosbodnak a szívszövet károsodásához, depressziós CO-hoz és disztribúciós sokkhoz. Meg kell jegyezni, hogy a CS egyes esetei iatrogének, amikor a szívelégtelenség küszöbén álló betegeket agresszív vizelethajtókkal, nitrátokkal, béta-blokkolókkal, ACEI-vel és morfiummal kezelik. 14 Ezért a sürgősségi orvosoknak a betegek értékelésének első orvosaként időérzékeny és klinikailag megfelelő módon kell azonosítaniuk és kezelniük a CS-t.
Klinikai értékelés
Klasszikusan a CS-ben szenvedő betegek nehézlégzéssel, mellkasi fájdalommal, fáradtsággal és / vagy a boka duzzanattal járó panaszokkal jelentkezik.15 A fizikális vizsgálat kimutathatja a torlódás jeleit, ideértve a perifériás ödémát, a jugularis vénás duzzanatot (JVD), az auskultáció ropogását / rázkódását és a hypoperfúzió jeleit, például hűvös, rosszul perfundált végtagok (2. táblázat). Egy 30 retrospektív, differenciálatlan sokkban szenvedő beteg áttekintésében a CS-ben szenvedő betegeknél nagyobb valószínűséggel volt JVD (80% 0, 20% -hoz képest), hideg bőr (57,1% 14,3% -hoz és 28,5% -hoz képest) és tüdő rale (75% vs 16,7% és 8,3%) a disztributív és a hypovolemiás sokkban szenvedőkhöz képest.16 Egy másik, 68 beteggel végzett prospektív vizsgálatban a rezidensek speciális klinikai vizsgálati eredményeket használtak a sokk kategóriáinak megkülönböztetésére. A CS-t az SBP szerint 90-nél kisebb kategóriába sorolták, az alacsony kimenet jelei (hideg kezek, gyenge kapilláris feltöltés és gyenge pulzus), emelkedett nyaki vénás nyomás (JVP) > 7 cmH2O, S3 vágta , és a tüdő 1/3-ig ropog. 68 beteg közül 11 megfelelt a CS kritériumainak. Azoknál a betegeknél, akiknek echokardiográfiásan alacsony a szívteljesítménye, az emelkedett JVP 80% -os pontossággal jósolta a CS-t, amely változatlan volt a repedések jelenlétének hozzáadásakor.17
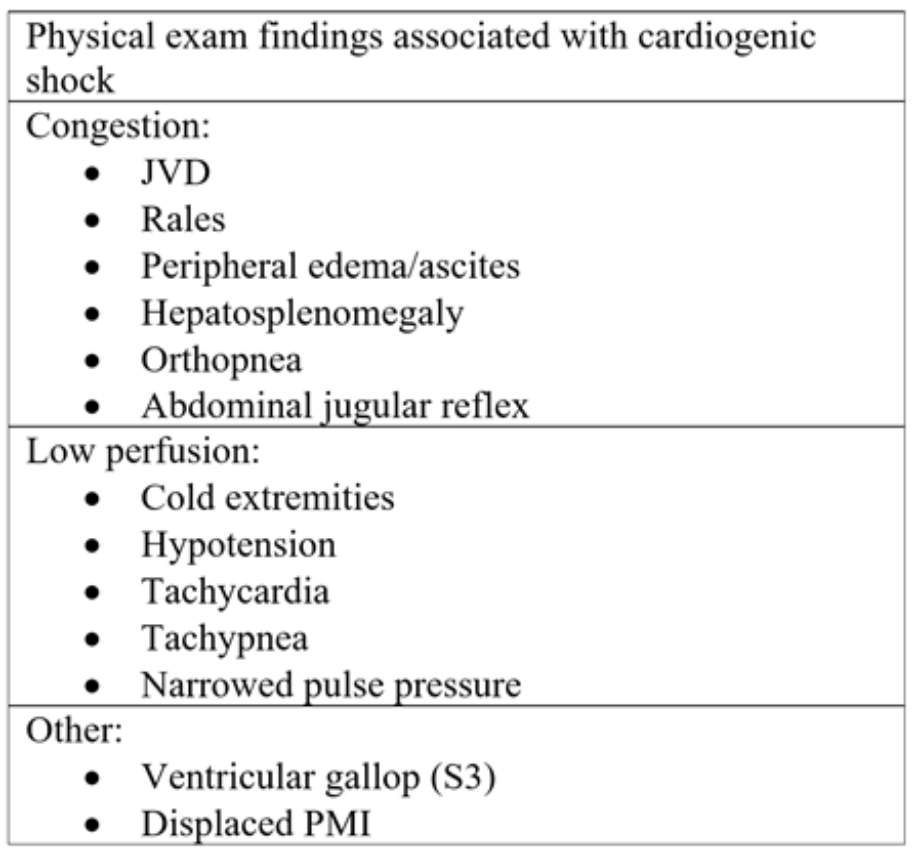
2. táblázat: Az akut szívelégtelenség és az azt követő kardiogén sokk esetén észlelhető fizikai vizsgaelemek. 18
Bár a JVP hasznos meghatalmazott az éknyomás emelkedésére, 19 nehéz lehet értékelni a test habitusa és a páciens elhelyezkedése miatt (az ágy fejét 45 fokkal meg kell emelni, ami nehéz lehet súlyos orthopnoában szenvedő betegeknél). 20 JVP-t úgy mérünk, hogy a legmagasabb pulzációs pontot cm-ben számoljuk ki a szegycsont felett, majd adjunk hozzá 5 (mivel a jobb pitvar 5 cm-rel a szegycsont alatt van), ami cmH20-ban való távolsággal korrelál (2. ábra). A megemelt értékeket gyakran 6-8 cmH-nál nagyobbnak tekintik. 20.18. Megjegyzendő, hogy az emelkedett JVP a halálozás fokozott kockázatával jár, relatív kockázata (RR) 1,52,18
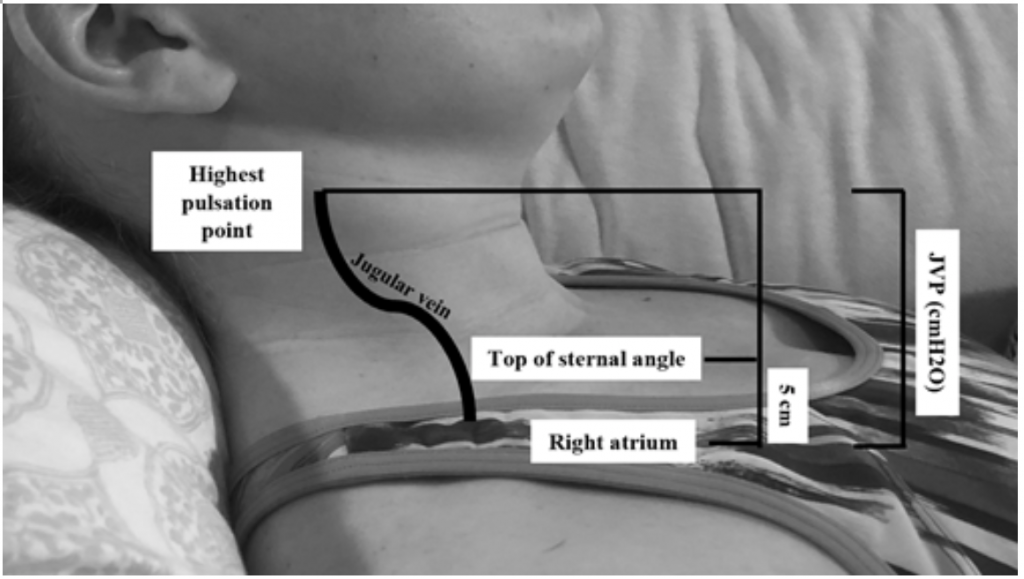
2. ábra: A JVP mérése, Shah & Cowger (2014) adaptálásával. 18
A laborok megjelenhetnek metabolikus acidózis (a laktát fokozódásával a perifériás ischaemia következtében), vese hypoperfúzió és ennek következtében fellépő akut vesekárosodás, valamint a szív iszkémiájának lehetséges bizonyítékai emelkedett troponin- és EKG-változásokkal. betegeknél a laktátszint szignifikánsan összefüggésbe hozta a megnövekedett mortalitást (a korrigált esélyarány 1,4) .6 Fontos megjegyezni, hogy a laktát emelkedése nem specifikus a szepszisre, és bármilyen hipoperfúz állapotban, például CS-ben is megfigyelhető.
Másrészt ezek a fizikai vizsgálati eredmények és a hemodinamikai paraméterek nem mindig igazak. A SHOCK Trial nyilvántartást használó vizsgálatban a CS-betegek 5,2% -ának nem volt nyilvánvaló hipotenziója, bár a perifériás hipoperfúzió jelei és az alacsony CI voltak. 21 Ez valószínűleg annak köszönhető, hogy a CS korai szakaszában adaptív katekolamin felszabadul, ami növeli a szisztémás vaszkuláris ellenállást ( SVR) és átmenetileg fenntartja a vérnyomást, bár általában keskeny pulzusnyomással. 22 Még azok a betegek is, akiknél a képalkotás során klinikailag jelentős tüdőödéma fordul elő, zihálás vagy akár tiszta tüdőhangokkal is járhat, nem pedig rázkódásokkal.23 Egy tanulmányban csak a kb. 2/3-os MI esete másodlagos MI.21 Ezen túlmenően, még a csökkent LV kontraktilitás mellett is, a CS betegeknél az LVEF nem csökkenhet súlyos mértékben. 14,24 Valójában a CS-betegek kohorszában az átlagos EF körülbelül 30%, ami csökkent, de magasabb a vártnál.2
Noha a vizsga nem tökéletes, a torlódás és a perifériás hipoperfúzió jeleit kutató részletes fizikai vizsga, valamint az életjelek és laboratóriumok gondos áttekintése lehet az első utalás arra, hogy a beteg kardiogén sokkban szenved.
ECHO az ellátás helyén a kardiogén sokk értékeléséhez
Amikor a betegek vérnyomáscsökkentő vagy hipoperfúzióban vannak, a RUSH-vizsga gyors módja a sokk megkülönböztetésének a “szivattyú, a tartály és a csövek. ”25,26 CS esetében a transthoracalis echokardiogram klasszikusan hipodinamikus, kitágult LV-t mutat, gyenge LV-szorítással és a mitralis szelep elülső szórólapjának nem megfelelő mozgásával a szisztolés és a diasztolés során (azaz rossz kontraktilitás). Az ejekciós frakció (EF) és a CO (CO = stroke térfogat (SV) x szívfrekvencia (HR)) becslése egyszerűen “szemgolyózó” LV szorítással az orvosok megfelelő értékelése akut körülmények között. 27 CS-ben az alsó vena cava (IVC), amely a hatékony intra közvetett mérése vaszkuláris térfogatának átmérőjének > 2 cm átmérőjűnek kell lennie, és inspirációval 50% -nál kisebb mértékben összeomlik. Ezek a megállapítások korrelálnak a megemelkedett centrális vénás nyomással.28 Az IVC-értékelés azonban pontatlan lehet, ha a beteg értágítókat, vizelethajtókat kapott és / vagy szellőztetett.29 A mellkasi ablakokban valószínűleg tüdőödéma jelentkezik túlzott B vonalak (“tüdőrakéták”), amelyek az interstitiumban lévő vízfelhalmozódás következtében kialakuló septum megvastagodásának eredményeként alakulnak ki.30 A tüdőtorlódás mellett előfordulhat pleurális és peritonealis folyadék is a RUSH-vizsgán.25 Egy metaanalízis során három eredeti tanulmányok és két esetjelentés szerint a RUSH protokoll érzékeny és specifikus (0,89, illetve 0,97) volt a CS diagnózisában. A magas, 22,29-es pozitív valószínűségi arány (LR) ellenére csak mérsékelten negatív volt LR 0,17, ami azt sugallja, hogy a RUSH vizsga nem a tökéletes teszt a CS kizárására. Ezért a RUSH vizsgát egy gondos kórtörténet és fizikai vizsga összefüggésében kell használni, nem pedig egyedül a cardiogeni diagnosztizálására. c sokk.
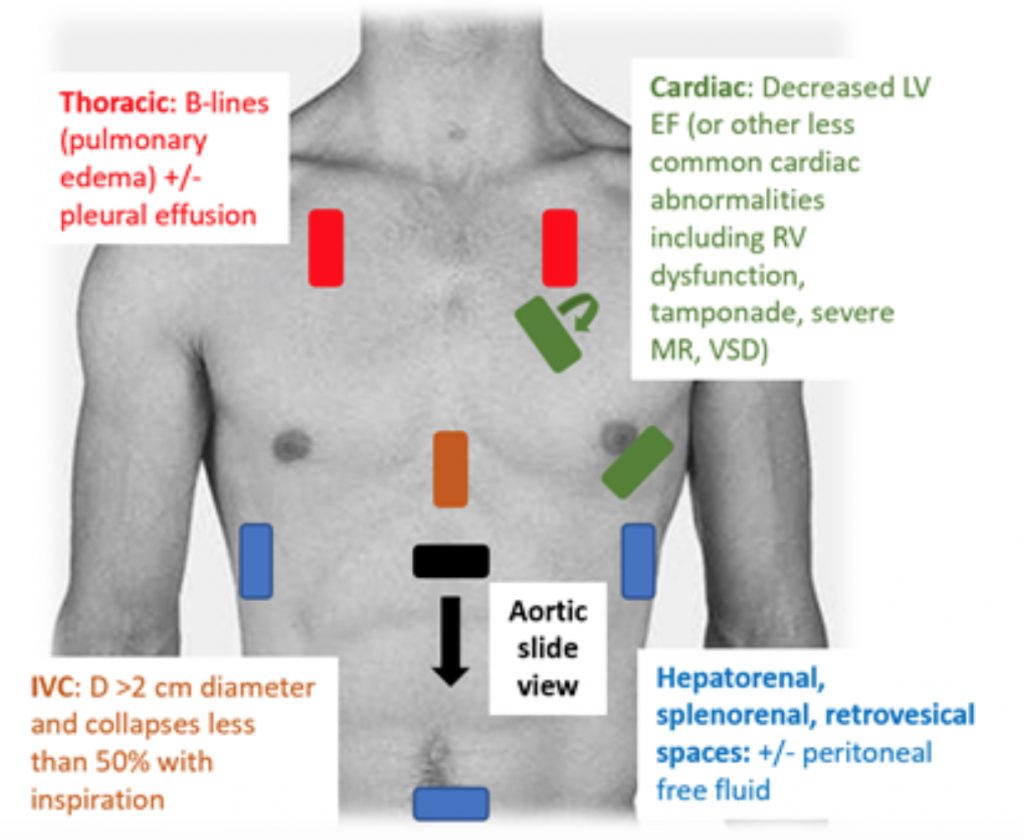
3. ábra: RUSH ágy melletti amerikai vizsga a differenciálatlan hipotenzió értékelésére, a CS.25-re utaló kapcsolódó megállapításokkal , 26,29,30
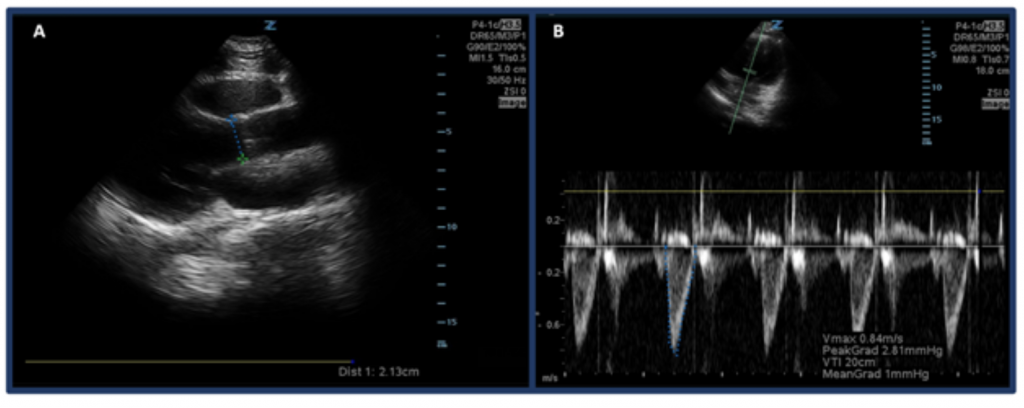
A CO “ultrahanggal történő becslése helyett a CO ultrahanggal történő mérésének egyik módja az, hogy először meghatározzuk az SV-t a bal kamrai kiáramló traktus sebességének időintervallumával (LVOT VTI, vagy a sebességek). véráramlás az aorta kiáramló traktuson) és az LVOT átmérője. Pontosabban, az SV-t, vagy a bal kamránként egy szívverésen keresztül leadott vér mennyiségét az LVOT VTI × az LVOT keresztmetszetének területe alapján számoljuk. az LVOT távolsága közvetlenül az aorta szelep felett, míg a szisztolé közepén van. A VTI-t az apikális-5 kamrás nézetben mérjük. Az impulzushullámú doppler mód használatával a doppler hullámot közvetlenül az aorta szelep fölé helyezzük, és rögzítjük a doppler hullámformáit. Ügyeljen arra, hogy a tengelyt a lehető legjobban egy vonalba állítsa a kiáramló traktussal, hogy elkerülje a túl / alul becsléseket. Az “LVOT VTI” mérőeszköz kiválasztása után mérje meg az egyik kilökési periódus hullámalakját. 33,34 A normál LVOT VTI 18-22 cm között mozog, bár valószínűleg alacsonyabb a HR > 95 bpm mellett. Pitvarfibrillációban szenvedő betegeknél a VTI-mérések valószínűleg alulbecsülik a valódi értéket, ezért 3-5 egymást követő hullámforma átlagolása javasolt. Amint az várható volt, összefüggés van az alacsony LVOT-VTI és a nemkívánatos eredmények között. >
Javasolt kiértékelési útvonal
Amint fentebb említettük, egyetlen vizsgalelet vagy laboratóriumi teszt sem képes diagnosztizálni CS. Ezért, ha magas a gyanúja a CS-nek a hipotenzió vagy a hipoperfúzió jeleinek hátterében, javasoljuk az előzmények, a részletes fizikai vizsga, az USA melletti laboratóriumok (különösen a kreatinin, laktát, troponin, BNP és más hipoperfúziós markerek) használatát. / vég-szervkárosodás) és EKG (mivel az akut MI a CS elsődleges oka és az ischaemia jelei, és szükségessé válhat revaszkularizáció) a diagnózis elősegítése érdekében (lásd 5. ábra). Vegyünk egy artériás katéter monitort a BP-hez, és irányítsuk a kezelést. A koncentrált szív- és tüdővizsgálaton túl a fizikai vizsgálatnak a JVD-re és a végtag perfúziójára kell összpontosítania. A fentebb tárgyalt RUSH-vizsga és az EF / CO / CI kiszámítása az LVOT VTI méréseken keresztül értékes kiegészítői az értékelésnek. Átfogó megközelítés alkalmazása a CS értékeléséhez jobban meg fogja érteni ezt a heterogén betegséget, és segít irányítani a kezelést. : További értékeléskor a beteg nyaki vénás nyomását 10 cmH20-ra emelik, és a lábai hűvösek késleltetett kapilláris feltöltéssel. Az ágy melletti RUSH vizsga kétoldali diffúz tüdőödémát és becsült alacsony EF-t mutat.Az LVOT VTI-t csak 10 cm-nél mérik. Az EKG ST magasságot mutat a precordiális vezetékekben. A laktát és a troponin enyhén emelkedett. A pácienst egy rövid dobutamin, IV furoszemid és CPAP kipróbálásával stabilizálják, a vitálok és a légzési állapot mérsékelt javulásával, majd ezt követően a katolikus laboratóriumba küldik a kialakuló PCI érdekében.
Vigye haza a pontokat:
- a CS-t elsősorban akut MI okozza (~ 70%), és ez a legtöbb tanulmány középpontjában áll, de más okokat is figyelembe kell venni (lásd: teljes lista az 1. ábrán).
- A CS által másodlagos halálozás továbbra is magas (~ 60%), bár a korai azonosítás és a beavatkozás javítja a túlélést.
- Gondos fizikai vizsgálatot végezzen a hipoperfúzió és a torlódás. A JVP a fizikális vizsga fontos eleme a CS diagnózisában, és a megnövekedett mortalitással jár (RR = 1,52).
- A RUSH vizsga érzékeny és specifikus (0,89, illetve 0,97) a CS. Az ágy melletti ultrahangot gyakran meg kell ismételni, mivel a legtöbb beteg kezdetben nem jelentkezik CS-ben.
- Az LVOT VTI használata egyszerű és nem invazív módszer a CO értékelésére, alacsony mérésekkel, amelyek káros hatásokkal járnak.
- Az 5. ábra foglalja össze a gyanús CS-ben szenvedő betegek értékelésének javasolt megközelítését, amelynek fókuszában annak heterogén patológiája és bemutatása áll.
FOAM-források:
- EM 5-ben : Sokk
- emDocs: Kardiogén sokk
- emDocs: A szívelégtelenség ED kezelése – gyöngyök és buktatók
- emDocs: RUSH (“Rapid Ultrasound for Shock”) Protokoll
- emDocs: A hipotenzív ED-beteg: szekvenciális szisztematikus megközelítés
- Első 10 EM: Differenciálatlan hipotenzió
