Przypadek: 73-letni mężczyzna z historią nadciśnienia, choroby wieńcowej i wcześniejszego mięśnia sercowego zawał (MI) zgłasza się na oddział ratunkowy (SOR) ze zmęczeniem, dusznością, zmniejszonym wydalaniem moczu i obrzękiem kostek. Po przybyciu na miejsce, jego objawy życiowe obejmują ciśnienie krwi 87/58 mm Hg, HR 102, RR 24, nasycenie T 86% w powietrzu pokojowym i temperaturę 98,2 F, a podczas osłuchiwania ma trzaski. Jak poradziłbyś sobie z tym pacjentem?
Co to jest wstrząs kardiogenny?
Chociaż definicje są różne, wstrząs kardiogenny (CS) jest rozpoznaniem klinicznym szeroko definiowanym jako stan niskiego rzutu serca z towarzyszącym niewystarczająca perfuzja narządów końcowych lub hipoperfuzja tkanek wtórna do uszkodzenia serca. 1 Powszechnie stosowane kryteria pochodzące z badania SHOCK obejmują niedociśnienie (SBP < 90 mmHg lub > 90 mmHg z leczeniem wspomagającym), dowód hipoperfuzja narządowa i wskaźnik sercowy (CI) < 2,2 l / min / m2 lub ciśnienie zaklinowania w kapilarach płucnych ≥ 15 mmHg 2,3 Chociaż ta definicja jest przydatna do standaryzacji kryteriów włączenia do badań klinicznych , ma mniejszą wartość w diagnostyce CS na oddziale ratunkowym (SOR). Podczas zmiany w ruchliwym SOR, zdiagnozowanie CS może być trudne ze względu na różne objawy, nakładanie się z innymi stanami wstrząsu (np. Posocznicą), słabo poznaną patofizjologią, złożone i wieloczynnikowe przyczyny oraz zróżnicowane parametry hemodynamiczne. (CO) i PCWP, CS można wywnioskować na podstawie dowodów na podwyższone ciśnienie napełniania (np. Zastój w płucach lub podwyższone JVP), kliniczne objawy hipoperfuzji oraz wywiad i echo sugerujące niewydolność serca. Śmiertelność wtórna do CS jest wysoka (~ 25-70%), ale wczesne rozpoznanie i interwencja poprawia przeżycie.4,5 Lekarze medycyny ratunkowej mają możliwość zdiagnozowania CS przy przyjęciu do szpitala i muszą zachować wysokie kliniczne podejrzenie w przypadku każdego krytycznie chorego pacjenta. Ten przegląd skupi się na rozpoznawaniu i wskazówkach, jak nie przegapić diagnozy CS podczas badania fizycznego, laboratoriów, ultrasonografii przy łóżku i obrazowania.
Jakie są przyczyny wstrząsu kardiogennego?
Większość badań dotyczących kortykosteroidów koncentruje się na pacjentach z kortykosteroidem wtórnym do zawału mięśnia sercowego (ang. Myocardial infarctions, MI) obejmującego lewą komorę. Chociaż zawał mięśnia sercowego jest główną przyczyną CS (~ 70%), należy wziąć pod uwagę każdą przyczynę dysfunkcji komór i obniżonego stężenia CO lub wskaźnika sercowego (CO / powierzchnia ciała) jako potencjalną przyczynę.6 Obejmuje to, ale nie ogranicza się do: niezwiązane z niedokrwieniem przyczyny prawokomorowej niewydolności serca, zapalenia mięśnia sercowego, kardiomiopatii takotsubo, kardiomiopatii przerostowej lub wad zastawkowych serca (tab. 1). Aby uczynić to trudniejszym, CS jest raczej stanem kontinuum niż statycznym, obejmującym od pogarszającej się niewydolności serca po oporny wstrząs z nieodwracalnym uszkodzeniem narządów końcowych (ryc. 1). CS staje się jeszcze bardziej zmienny wraz z pojawieniem się wtórnych urazów, takich jak arytmie lub postępujące niedokrwienie i kwasica.3 Należy zauważyć, że w 2/3 przypadków CS nie występuje przy przyjęciu, ale później rozwija się w ciągu 48 godzin od hospitalizacji, gdy pacjent postępuje zgodnie z ciągłym wstrząsem7. Ważne jest, aby często ponownie oceniać parametry życiowe pacjenta, objawy, badanie przedmiotowe i echo przy łóżku.

Tabela 1: Przyczyny CS na podstawie Parrillo & Dellinger (2013) .8 70% przypadków CS jest spowodowanych ostrym MI.6 Skutki ostrego MI z towarzyszącym wartości procentowe zaczerpnięte z wyników rejestru prób SHOCK.9.10
Rysunek 1: Continuum of CS, zaadaptowano z Bellumkonda i in. . (2018) .3 To spektrum może się różnić w przypadku wtórnych urazów (np. Nowych arytmii).
Śmiertelność we wstrząsie kardiogennym
Chociaż śmiertelność wtórna do CS pozostaje wysoka, 4 wczesne rozpoznanie i interwencja poprawia przeżycie.5 Na podstawie danych, które obejmowały rejestr badań SHOCK, śmiertelność wewnątrzszpitalna w ciągu 30 dni u 1217 pacjentów, u których zdiagnozowano CS wtórną do niewydolności lewej komory (LV) lub prawej komory (RV) z powodu ostrego MI wyniosła 57% . Jeśli weźmiesz pod uwagę kilka czynników ryzyka, w szczególności wstrząs przy przyjęciu, wiek, przeszczepienie pomostów wieńcowych (CABG), inny zawał mięśnia sercowego, kreatynina > 1,9 mg / dl, zmniejszone SBP, niedotlenienie uraz mózgu i kliniczne dowody hipoperfuzji narządów końcowych, pacjentów można podzielić ze śmiertelnością wahającą się od 12% do 88% .11 W badaniu GRACE CS słabo, ale znacząco zmniejszył się w latach 1999-2006, prawdopodobnie z powodu zwiększonego stosowania przezskórnego interwencja wieńcowa (PCI), ważna forma wczesnej interwencji u pacjentów z MI powikłanym przez CS.12. Nawet w przypadku stratyfikacji pacjentów na podstawie czynników ryzyka PCI i CABG przyniosły korzyści zarówno pacjentom niskiego, jak i wysokiego ryzyka.11 Wczesna diagnoza i odpowiednie leczenie pozostaje, szczególnie w przypadku niedokrwienia mięśnia sercowego, istotnego modyfikowalnego czynnika wpływającego na wyniki u pacjentów z CS.
Ponadto, im dłuższy postęp CS, tym większe prawdopodobieństwo wystąpienia nieprawidłowego stanu zapalnego. odpowiedź wtórna do wzrostu cytokin, takich jak TNF-alfa i IL-6, które hamują czynność serca. 4,13 Występuje również wzrost wazopresyny i angiotensyny II, co zwiększa obciążenie następcze, pogarsza CO oraz zwiększa retencję wody i soli, powodując w ten sposób obrzęk płuc. Podwyższenie poziomu tlenku azotu (NO) jest również spowodowane aktywacją syntazy NO, co prowadzi do rozszerzenia naczyń krwionośnych i depresji mięśnia sercowego. Wszystkie te nieprzystosowawcze odpowiedzi na niski poziom CO i niedokrwienie mięśnia sercowego prowadzą do pogorszenia uszkodzenia tkanki serca, obniżenia poziomu CO i szoku dystrybucyjnego. Należy zwrócić uwagę, że niektóre przypadki kortykosteroidów są jatrogenne, gdy pacjenci na skraju niewydolności serca są leczeni agresywnymi lekami moczopędnymi, azotanami, beta-blokerami, ACEI i morfiną. 14 Dlatego jako pierwszy lekarz oceniający pacjentów, lekarze medycyny ratunkowej muszą identyfikować i leczyć CS w sposób uwzględniający czas i odpowiedni klinicznie.
Ocena kliniczna
Klasycznie, pacjenci z CS obecne z dolegliwościami w postaci duszności, bólu w klatce piersiowej, zmęczenia i / lub obrzęku kostek.15 Badanie przedmiotowe może ujawnić oznaki przekrwienia, w tym obrzęk obwodowy, rozdęcie żył szyjnych (JVD), trzaski / rzężenia podczas osłuchiwania oraz oznaki hipoperfuzji, takie jak chłód, słabo perfundowane kończyny (tab. 2). W niewielkim retrospektywnym przeglądzie 30 pacjentów w niezróżnicowanym wstrząsie ci z CS częściej mieli JVD (80% w porównaniu z 0% i 20%), zimną skórę (57,1% w porównaniu z 14,3% i 28,5%) i rales (75% vs 16,7% i 8,3%) w porównaniu z pacjentami, odpowiednio, ze wstrząsem dystrybucyjnym i hipowolemicznym.16 W innym prospektywnym badaniu z udziałem 68 pacjentów rezydenci wykorzystali określone wyniki badań klinicznych w celu zróżnicowania kategorii wstrząsu. CS zostało sklasyfikowane według SBP poniżej 90, oznaki niskiej wydajności (zimne dłonie, słabe wypełnienie naczyń włosowatych i słaby puls), podwyższone ciśnienie żylne szyjne (JVP) > 7 cmH2O, galop S3 i trzeszczy do 1/3 płuc. Spośród 68 pacjentów 11 spełniło kryteria CS. U pacjentów z echokardiograficznymi dowodami niskiego rzutu serca podwyższony JVP przewidywał CS z dokładnością 80%, która pozostała niezmieniona po dodaniu obecności trzasków.17
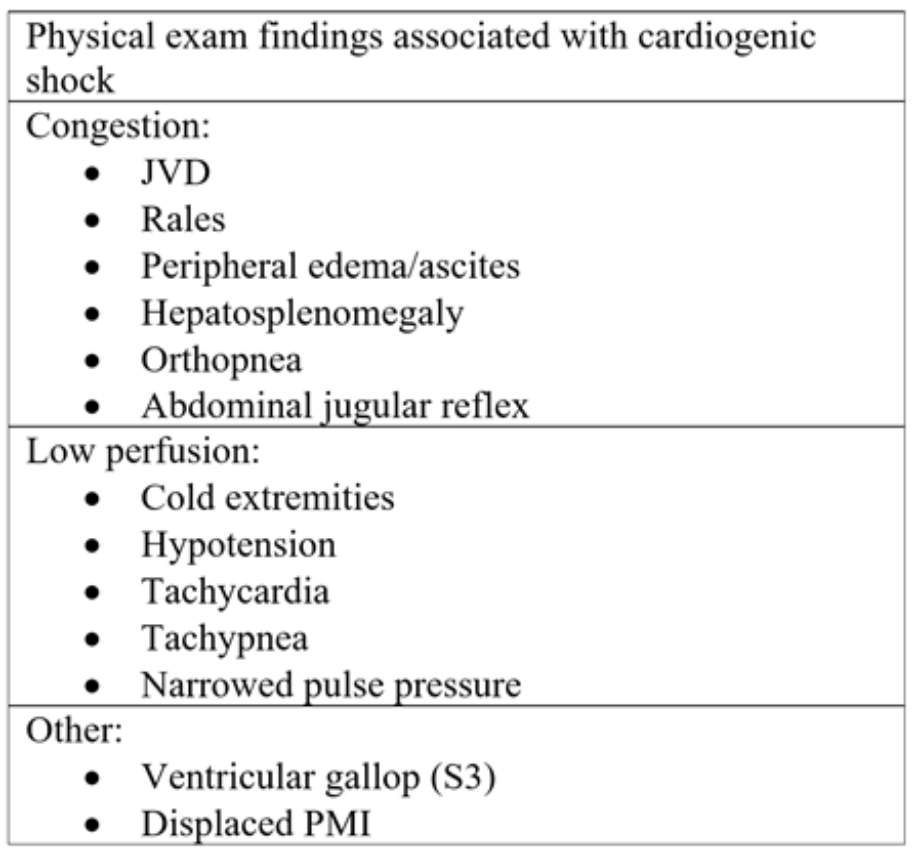
Tabela 2: Fizyczne elementy badania widoczne w ostrej niewydolności serca i późniejszym wstrząsie kardiogennym18
Chociaż JVP jest użytecznym wskaźnikiem zastępczym dla podwyższonych ciśnień zaklinowania19, ocena może być trudna ze względu na budowę ciała i ułożenie pacjenta (głowa łóżka powinna być podniesiona o 45 stopni, co może być trudne u pacjentów z ciężką ortopneą) .20 JVP mierzy się poprzez obliczenie najwyższego punktu pulsacji w cm powyżej kąta mostka, a następnie dodanie 5 (ponieważ prawy przedsionek znajduje się 5 cm poniżej kąta mostka), co koreluje z rozdęciem w cmH20 (ryc. 2). Podwyższone wartości są często uważane za większe niż 6-8 cmH20,18. Należy zauważyć, że podwyższony JVP jest związany ze zwiększonym ryzykiem śmiertelności, przy względnym ryzyku (RR) 1,52,18
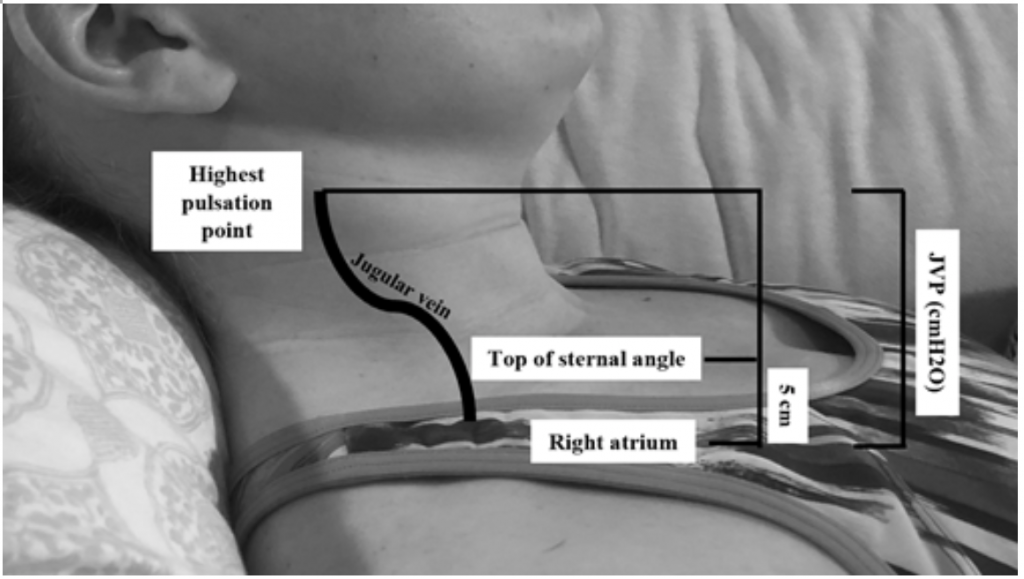
Rysunek 2: Pomiar JVP na podstawie Shah & Cowger (2014) .18
Laboratoria mogą pokazać kwasica metaboliczna (wraz ze wzrostem mleczanu z powodu niedokrwienia obwodowego), hipoperfuzja nerek z następczym ostrym uszkodzeniem nerek i możliwe objawy niedokrwienia serca z podwyższoną troponiną i zmianami EKG.15 W badaniu CardShock, wieloośrodkowym, prospektywnym, obserwacyjnym badaniu 219 CS pacjentów poziom mleczanu był istotnie powiązany ze zwiększoną śmiertelnością (skorygowany iloraz szans 1,4) 6. Należy zauważyć, że zwiększenie stężenia mleczanów nie jest specyficzne dla posocznicy i może być widoczne w każdym stanie hipoperfuzji, takim jak CS.
Z drugiej strony, te wyniki badań fizycznych i parametry hemodynamiczne nie zawsze są prawdziwe. W badaniu wykorzystującym rejestr SHOCK Trial, 5,2% pacjentów z kortykosteroidem nie miało jawnego niedociśnienia, chociaż miało objawy obwodowej hipoperfuzji i niskiego CI (21). Jest to prawdopodobnie spowodowane adaptacyjnym uwalnianiem katecholamin we wczesnym CS, co zwiększa ogólnoustrojowy opór naczyniowy ( SVR) i przejściowo utrzymuje ciśnienie krwi, chociaż zwykle przy wąskim ciśnieniu tętna.22 Nawet u pacjentów z klinicznie istotnym obrzękiem płuc w obrazowaniu obrazowym może wystąpić świszczący oddech lub nawet wyraźne szmery w płucach, a nie rzężenie.23 W jednym badaniu zastój płuc około 2/3 przypadków CS wtórnego do MI.21 Ponadto, nawet przy zmniejszonej kurczliwości LV, pacjenci z CS mogą nie mieć znacznego zmniejszenia LVEF. 14,24 W rzeczywistości średnia EF w kohorcie pacjentów z CS wynosi około 30%, czyli jest zmniejszona, ale wyższa niż oczekiwano.2
Chociaż badanie nie jest idealne, szczegółowe badanie fizykalne w celu wykrycia objawów zatorów i hipoperfuzji obwodowej wraz z dokładnym przeglądem parametrów życiowych i badań laboratoryjnych może być pierwszą wskazówką, że pacjent ma wstrząs kardiogenny.
Punkt opieki medycznej ECHO do oceny wstrząsu kardiogennego
Gdy pacjenci zgłaszają się do ED z hipotensją lub hipoperfuzją, badanie RUSH jest szybkim sposobem na rozróżnienie wstrząsu, patrząc na „pompę, zbiornik i rury ”. 25,26 W przypadku CS, echokardiogram przezklatkowy klasycznie wykazuje hipodynamiczną, poszerzoną LV, ze słabym uciskiem LV i związanym z tym niewystarczającym ruchem przedniego płatka zastawki mitralnej podczas skurczu i rozkurczu (tj. słabej kurczliwości). Oszacowanie frakcji wyrzutowej (EF) i CO (jako CO = objętość wyrzutowa (SV) x częstość akcji serca (HR)) za pomocą zwykłego ucisku LV przez „gałkę oczną” jest odpowiednią oceną lekarzy w ostrym położeniu.27 W CS, dolna żyła główna cava (IVC), która jest pośrednim pomiarem efektywnej intra objętość naczyniowa, powinna mieć średnicę > 2 cm średnicy i zapada się mniej niż 50% podczas wdechu. Te wyniki korelują z podwyższonym centralnym ciśnieniem żylnym.28 Jednak ocena IVC może być niedokładna, jeśli pacjent otrzymywał już leki rozszerzające naczynia krwionośne, diuretyki i / lub jest wentylowany.29 W oknach piersiowych prawdopodobnie wystąpi obrzęk płuc w postaci nadmiernego B linie („rakiety płucne”), które są wynikiem zgrubienia przegrody od gromadzenia się wody w śródmiąższu30. Wraz z zastojem płuc w badaniu RUSH może pojawić się płyn opłucnowy i otrzewnowy.25 W metaanalizie wykorzystującej dane z trzech oryginalnych pracach i dwóch opisach przypadków wykazano, że protokół RUSH jest zarówno czuły, jak i specyficzny (odpowiednio 0,89 i 0,97) w rozpoznaniu CS.31 Pomimo wysokiego wynikowego wskaźnika prawdopodobieństwa pozytywnego (LR) wynoszącego 22,29, stwierdzono jedynie umiarkowany ujemny LR 0,17, co sugeruje, że badanie RUSH nie jest idealnym testem do wykluczenia CS. Dlatego badanie RUSH powinno być stosowane w kontekście dokładnej historii i badania fizykalnego, a nie tylko do diagnozowania kardiogenów c.
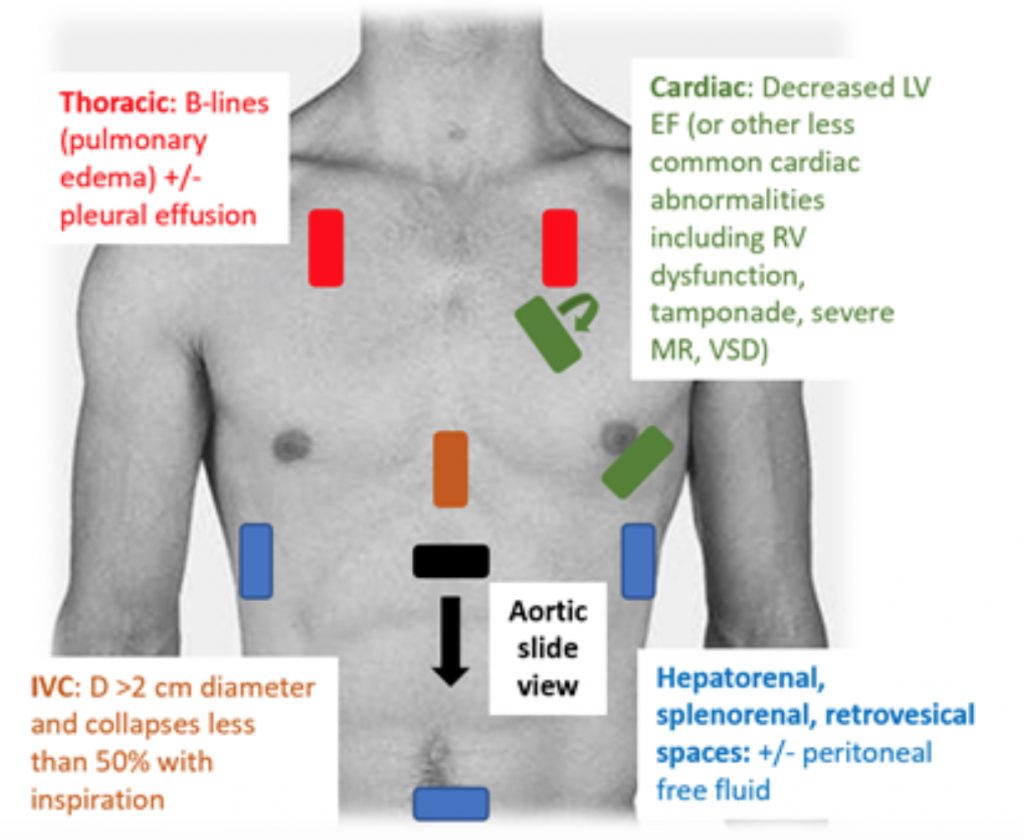
Ryc. 3: Badanie RUSH w przyłóżkowym USG w celu oceny niezróżnicowanego niedociśnienia z powiązanymi wynikami sugerującymi CS.25 , 26,29,30
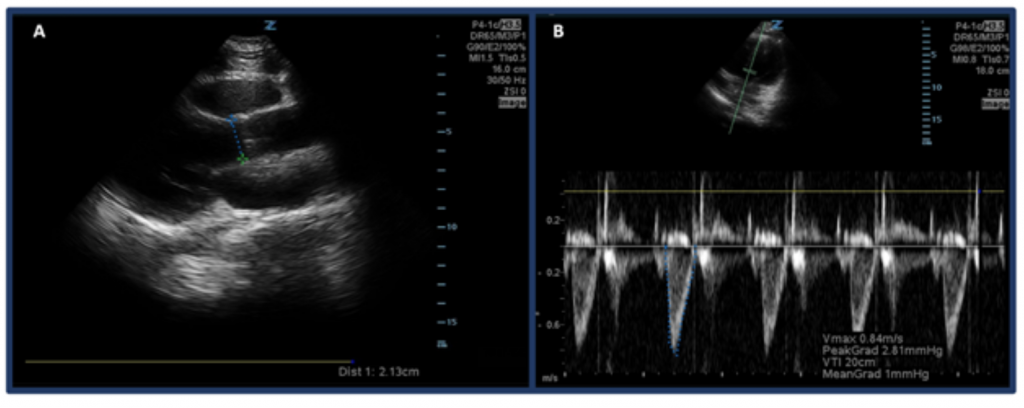
Zamiast szacowania CO na podstawie „gałki ocznej”, jednym ze sposobów pomiaru CO za pomocą ultradźwięków jest najpierw określenie SV przy użyciu przedziału czasowego prędkości odpływu lewej komory (LVOT VTI lub prędkości przepływu krwi w drogach odpływu aorty) i średnicy LVOT. W szczególności SV, czyli ilość krwi wyrzucanej przez lewą komorę na uderzenie, jest obliczana przez LVOT VTI × pole przekroju poprzecznego LVOT.32 Aby zmierzyć średnicę LVOT, umieść sondę z układem fazowym w projekcji przymostkowej w osi długiej i zmierz odległość LVOT tuż nad zastawką aortalną w trakcie skurczu środkowego. VTI mierzy się w widoku koniuszkowym-5-jamowym. Wykorzystując tryb dopplerowski fali pulsacyjnej, falę dopplerowską umieszcza się tuż nad zastawką aortalną i rejestruje się przebiegi dopplerowskie. Aby uniknąć zawyżenia / niedoszacowania szacunków, należy jak najlepiej wyrównać oś z drogą odpływu. Po wybraniu narzędzia pomiarowego „LVOT VTI” zmierzyć przebieg jednego okresu wyrzutu. 33,34 Normalna wartość LVOT VTI waha się w zakresie 18–22 cm, chociaż prawdopodobnie jest niższa przy HR >
Zalecana ścieżka oceny
Jak wspomniano powyżej, nie ma ani jednego wyniku egzaminu ani testu laboratoryjnego, który mógłby zdiagnozować CS.W związku z tym, gdy istnieje duże podejrzenie CS w przypadku niedociśnienia lub objawów hipoperfuzji, sugerujemy skorzystanie z wywiadu, szczegółowego badania fizykalnego, przy łóżku US, laboratoriów (szczególnie kreatynina, mleczan, troponina, BNP i inne markery hipoperfuzji). / uszkodzenie narządu końcowego) i EKG (ponieważ ostry MI jest główną przyczyną CS i oznak niedokrwienia i może wymagać nagłego rewaskularyzacja) w celu ułatwienia diagnozy (patrz ryc.5). Weź pod uwagę cewnik tętniczy monitorujący ciśnienie krwi i poprowadź leczenie. Poza skupionym badaniem serca i płuc, badanie przedmiotowe powinno skupiać się na JVD i perfuzji kończyn. Omówione powyżej badanie RUSH i obliczenia EF / CO / CI poprzez pomiary LVOT VTI są cennymi dodatkami do oceny. Zastosowanie kompleksowego podejścia do oceny CS pozwoli lepiej zrozumieć tę heterogenną chorobę i pomoże w zarządzaniu.
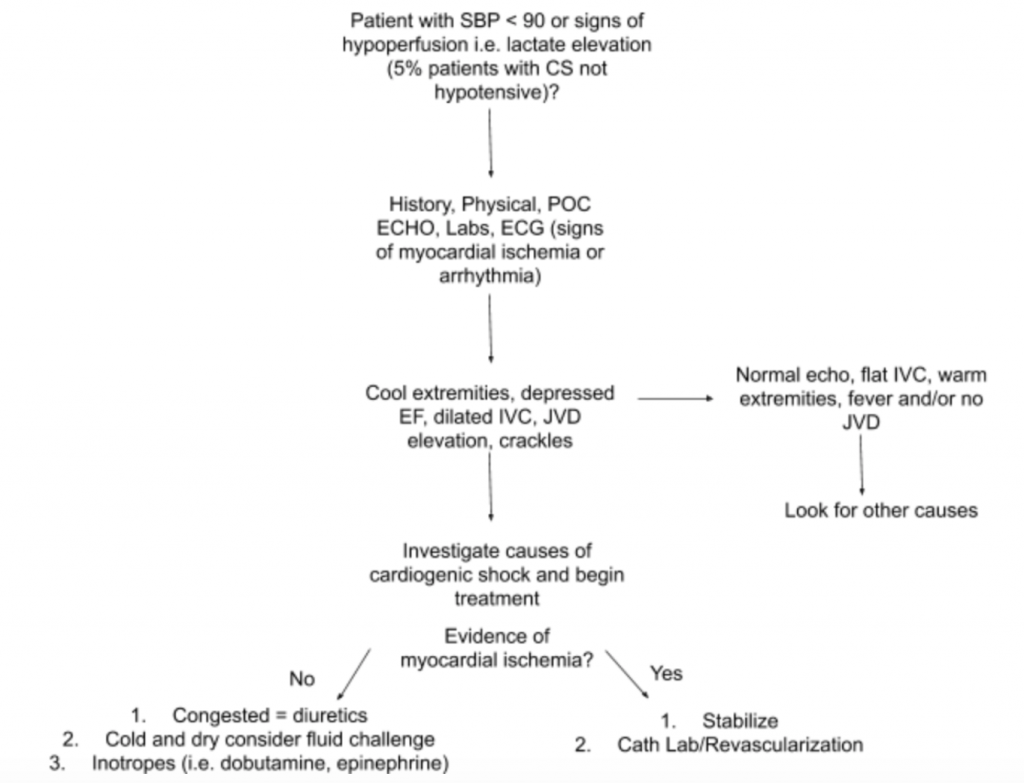
Wniosek : Przy dalszej ocenie ciśnienie w żyle szyjnej pacjenta jest podwyższone do 10 cmH20, a jego stopy są chłodne z opóźnionym napełnianiem naczyń włosowatych. Przyłóżkowe badanie RUSH wykazuje obustronny rozlany obrzęk płuc i szacunkową niską EF.LVOT VTI mierzy się tylko na 10 cm. EKG pokazuje uniesienia odcinka ST w odprowadzeniach przedsercowych. Lekko podwyższone stężenie mleczanów i troponiny. Pacjent jest stabilizowany krótką próbą dobutaminy, dożylnie furosemidu i CPAP z umiarkowaną poprawą funkcji życiowych i stanu układu oddechowego, a następnie wysyłany do pracowni cath lab na pilną PCI.
Podsumuj:
- CS jest głównie spowodowany ostrym MI (~ 70%) i jest przedmiotem większości badań, ale należy również wziąć pod uwagę inne przyczyny (patrz pełna lista na Ryc. 1).
- Śmiertelność wtórna do CS pozostaje wysoka (~ 60%), chociaż wczesna identyfikacja i interwencja poprawia przeżycie.
- Wykonaj dokładne badanie fizykalne pod kątem hipoperfuzji i przekrwienie. JVP jest ważnym elementem badania fizykalnego w diagnostyce CS i wiąże się ze zwiększoną śmiertelnością (RR = 1,52).
- Badanie RUSH jest zarówno czułe, jak i specyficzne (odpowiednio 0,89 i 0,97) w diagnostyce CS. USG przy łóżku powinno być często powtarzane, ponieważ większość pacjentów początkowo nie występuje w CS.
- Stosowanie LVOT VTI jest prostą i nieinwazyjną metodą oceny CO z niskimi pomiarami związanymi z niekorzystnymi skutkami.
- Sugerowane podejście do oceny pacjentów z podejrzeniem CS, z naciskiem na jego heterogenną patologię i prezentację, podsumowano na rycinie 5.
FOAMed Resources:
- EM w 5 : Shock
- emDocs: Cardiogenic Shock
- emDocs: ED Zarządzanie niewydolnością serca – perły i pułapki
- emDocs: RUSH („Rapid Ultrasound for Shock”) Protokół
- emDocs: Hipotensyjny pacjent z ED: sekwencyjne podejście systemowe
- Pierwsze 10 EM: niezróżnicowane niedociśnienie
