Fall: En 73-årig man med en historia av högt blodtryck, kranskärlssjukdom och tidigare hjärtinfarkt infarkt (MI) presenteras för akutmottagningen (ED) med trötthet, andfåddhet, minskad urinproduktion och svullnad i fotleden. Vid ankomsten inkluderar hans vitala tecken BP 87/58 mm Hg, HR 102, RR 24, T-mättnad 86% på rumsluft och temperatur 98,2 F, och han har knakande på auskultation. Hur skulle du hantera den här patienten?
Vad är kardiogen chock?
Även om definitionerna varierar är kardiogen chock (CS) en klinisk diagnos som i stor utsträckning definieras som ett tillstånd med låg hjärtutgång med tillhörande otillräcklig slutorganperfusion eller vävnadshypoperfusion sekundärt till hjärtskador. 1 Vanligt använda kriterier från SHOCK-studien består av hypotoni (SBP < 90mmHg eller > 90mmHg med stödjande vård), bevis på slut- organhypoperfusion och hjärtindex (CI) < 2,2 L / min / m2 eller lungkapillärt kiltryck ≥ 15 mmHg 2,3 Även om denna definition är användbar för att standardisera inkluderingskriterier för kliniska prövningar , är det mindre värdefullt för diagnos av CS i akutmottagningen (ED). Vid skift i en upptagen ED kan CS vara svårt att diagnostisera på grund av de olika presentationerna, överlappning med andra chocktillstånd (dvs. sepsis), dåligt förstådd patofysiologi, komplexa och multifaktoriella orsaker och varierade hemodynamiska parametrar.4 I frånvaro av invasiv hjärtutgång (CO) och PCWP-värden, CS kan härledas med hjälp av bevis på förhöjda fyllningstryck (dvs. lungstockningar eller förhöjt JVP), kliniska tecken på hypoperfusion och en historia och eko som tyder på hjärtsvikt. Dödligheten sekundär till CS är hög (~ 25-70%), men tidigt erkännande och intervention förbättrar överlevnaden.4,5 Akutläkare har möjlighet att diagnostisera CS vid inläggning och måste upprätthålla en hög klinisk misstanke när man ser någon kritiskt sjuk patient. Denna recension kommer att fokusera på igenkänning och tips om hur man inte missar diagnosen CS genom fysisk undersökning, laboratorier, ultraljud vid sängen och bildbehandling.
Vad är orsakerna till kardiogen chock?
De flesta studier av CS fokuserar på patienter med CS sekundärt till hjärtinfarkt (MI) som involverar vänster kammare. Även om MI är den främsta orsaken till CS (~ 70%), måste varje orsak till kammardysfunktion och minskat CO- eller hjärtindex (CO / kroppsyta) som en potentiell orsak övervägas.6 Detta inkluderar, men är inte begränsat till, icke-ischemiska orsaker till höger hjärtsvikt, myokardit, takotsubo-kardiomyopati, hypertrofisk kardiomyopati eller hjärt-kärlsjukdom (tabell 1). För att göra saker mer utmanande är CS ett kontinuum snarare än ett statiskt tillstånd, allt från förvärrad hjärtsvikt till eldfast chock med irreversibel organskada (Figur 1). CS blir ännu mer varierande med sekundära förolämpningar som arytmier eller progressiv ischemi och acidos.3 Det bör noteras att i 2/3 av fallen är CS inte närvarande vid inläggning men utvecklas senare inom 48 timmar efter sjukhusvistelse som patienten fortsätter ned chockkontinuiteten.7 Det är viktigt att ofta omvärdera patienternas vitala tecken, symtom, fysisk undersökning och eko vid sängen.

Tabell 1: Orsaker till CS, anpassad från Parrillo & Dellinger (2013). 8 70% av CS-fallen orsakas av akuta MI.6 Effekter av akut MI med associerad procenttal från resultaten av SHOCK-testregistret.9.10
Figur 1: Kontinuerlig CS, anpassad från Bellumkonda et al . (2018) .3 Detta spektrum kan avvika med sekundära förolämpningar (t.ex. nya arytmier).
Dödlighet vid kardiogen chock
Även om dödligheten sekundär till CS förblir hög, är 4 tidigt erkännande och intervention förbättrar överlevnad.5 Med hjälp av data som inkluderade SHOCK-testregistret, 30-dagars sjukhusdödlighet hos 1 217 patienter som diagnostiserades med CS sekundärt till vänster kammare (LV) eller höger kammare (RV) på grund av en akut MI var 57% . Om du tar flera riskfaktorer i beaktande, specifikt chock vid intag, ålder, tidigare kranskärlspassning (CABG), icke-sämre MI, kreatinin > 1,9 mg / dL, minskad SBP, anoxisk hjärnskada och kliniska bevis på hyporganfusion i slutet av organet, kunde patienter delas upp med dödlighet från 12% till 88% .11 I GRACE-studien minskade CS svagt men signifikant mellan 1999 och 2006, troligtvis på grund av den ökade användningen av perkutan koronar intervention (PCI), en viktig form av tidigt ingripande för patienter med MI komplicerad av CS.12 Även vid stratifiering av patienter baserat på riskfaktorer gynnades PCI och CABG både låg- och högriskpatienter.11 Tidig diagnos och lämplig behandling kvarstår, särskilt i fallet med hjärtinfarkt, en viktig modifierbar bidragsgivare till resultaten för patienter med CS.
Ju längre CS utvecklas, desto mer sannolikt kommer det att finnas en otillräcklig inflammatorisk svar sekundärt till en ökning av cytokiner som TNF-alfa och IL-6, som hämmar hjärtaktivitet. 4,13 Det finns också en ökning av vasopressin och angiotensin II, vilket ökar efterbelastningen, förvärrar CO och ökar vatten- och saltretentionen, vilket orsakar lungödem. Kväveoxid (NO) ökar också genom aktivering av NO-syntas, vilket leder till vasodilatation och hjärtinfarkt depression. Alla dessa maladaptiva reaktioner på låg CO och hjärtinfarkt leder till försämrad hjärtvävnadsskada, deprimerad CO och distribuerande chock. Det bör noteras att vissa fall av CS är iatrogena, när patienter på gränsen till hjärtsvikt behandlas med aggressiva diuretika, nitrater, betablockerare, ACEI och morfin. 14 Som första läkare som utvärderar patienter måste akutläkare därför identifiera och behandla CS på ett tidskänsligt och kliniskt lämpligt sätt.
Klinisk utvärdering
Klassiskt, patienter med CS närvarande med klagomål om dyspné, bröstsmärtor, trötthet och / eller svullnad i fotleden.15 Fysisk undersökning kan avslöja tecken på trängsel inklusive perifert ödem, jugular venous distension (JVD), krakningar / rales vid auskultation och tecken på hypoperfusion som cool, dåligt perfuserade extremiteter (tabell 2). I en liten retrospektiv genomgång av 30 patienter i odifferentierad chock var de med CS mer benägna att ha JVD (80% jämfört med 0% och 20%), kall hud (57,1% jämfört med 14,3% och. 28,5%) och lung rales (75% mot 16,7% och 8,3%) jämfört med patienter med distribuerad respektive hypovolemisk chock.16 I en annan prospektiv studie med 68 patienter använde invånarna specifika kliniska undersökningsresultat för att differentiera kategorier av chock. CS kategoriserades efter SBP mindre än 90, tecken på låg effekt (kalla händer, dålig kapillärpåfyllning och svag puls), förhöjt jugulärt venöst tryck (JVP) > 7 cmH2O, S3 galopp och sprakar till 1/3 av lungorna. Av 68 patienter uppfyllde 11 kriterier för CS. Hos patienter med ekokardiografiskt bevis på låg hjärtproduktion förutspådde förhöjd JVP CS med en noggrannhet på 80%, vilket var oförändrat när man lägger till närvaron av krakningar.17
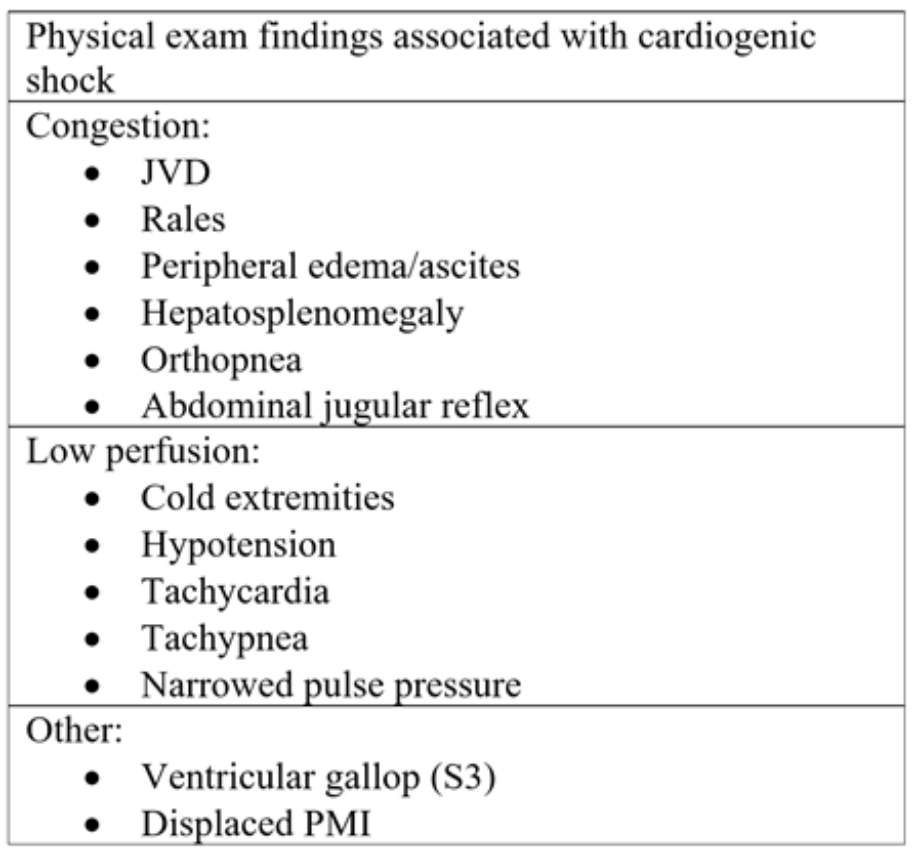
Tabell 2: Fysiska undersökningskomponenter sett vid akut hjärtsvikt och efterföljande kardiogen chock.18
Även om JVP är en användbar proxy för förhöjda kiltryck, 19 kan det vara svårt att bedöma på grund av kroppens vana och positionering av patienten (sänghuvudet ska vara förhöjt 45 grader vilket kan vara svårt för patienter med svår ortopné.) 20 JVP mäts genom att beräkna den högsta pulseringspunkten i cm ovanför bröstbenets vinkel och lägg sedan till 5 (eftersom det högra förmaket är 5 cm under sternalvinkeln), vilket korrelerar med distansen i cmH20 (figur 2). Förhöjda värden anses ofta vara större än 6-8 cmH20.18 Observera att förhöjd JVP är förknippat med ökad risk för dödlighet, med en relativ risk (RR) på 1.52.18
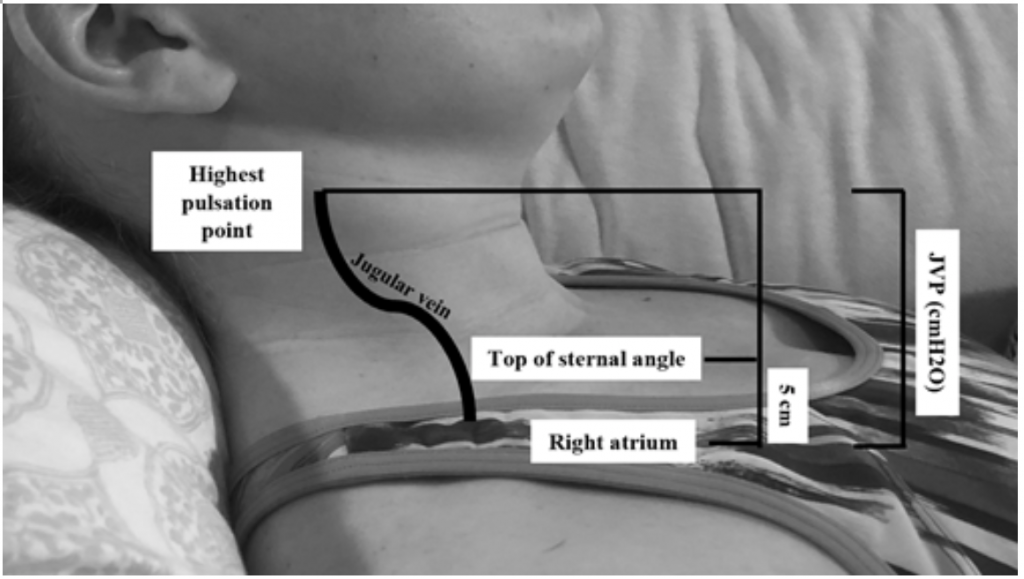
Figur 2: Mätning av JVP, anpassad från Shah & Cowger (2014) .18
Labs kan visa en metabolisk acidos (när laktat ökar på grund av perifer ischemi), njurhypoperfusion med resulterande akut njurskada och möjliga tecken på hjärt-ischemi med förhöjt troponin och EKG-förändringar.15 I CardShock-studien, en multicenter, prospektiv, observationsstudie av 219 CS patienter var laktatnivåerna signifikant associerade med ökad dödlighet (justerat oddsförhållande 1,4) .6 Det är viktigt att notera att förhöjning av laktat inte är specifik för sepsis och kan ses i alla hypoperfuserade tillstånd som CS.
Å andra sidan stämmer inte dessa fysiska undersökningsresultat och hemodynamiska parametrar. I en studie som använde SHOCK Trial-registret hade 5,2% av CS-patienterna inte uppenbar hypotoni även om de hade tecken på perifer hypoperfusion och låg KI.21 Detta beror troligen på en adaptiv katekolaminfrisättning i början av CS, vilket ökar systemisk vaskulär resistens ( SVR) och upprätthåller kortvarigt blodtrycket, men i allmänhet med ett smalt pulstryck.22 Även patienter med kliniskt signifikant lungödem vid avbildning kan uppträda med väsande andning eller till och med tydliga lungljud snarare än rales.23 I en studie sågs lungträngsel endast i cirka 2/3 fall av CS sekundärt till MI.21 Dessutom, även med minskad LV-kontraktilitet, kan CS-patienter inte ha en allvarlig minskning av LVEF. 14,24 Faktum är att medelvärdet för EF i en kohort av CS-patienter är cirka 30%, vilket är minskat men högre än förväntat.2
Även om undersökningen inte är perfekt, kan en detaljerad fysisk undersökning som söker tecken på trängsel och perifer hypoperfusion tillsammans med en noggrann genomgång av vitala tecken och laboratorier vara den första ledtråden för att din patient har kardiogen chock.
Vårdpunkt ECHO för utvärdering av kardiogen chock
När patienter som är närvarande vid ED hypotensiv eller hypoperfuserad är RUSH-undersökningen ett snabbt sätt att differentiera chock genom att titta på ”pumpen, tanken och rören. ”25,26 För CS visar transthoracic echocardiogram klassiskt en hypodynamisk, utvidgad LV, med dålig LV-klämning och associerad otillräcklig rörelse av den främre broschyren för mitralventilen under systol och diastol (dvs. dålig sammandragning). Uppskattning av ejektionsfraktion (EF) och CO (som CO = slagvolym (SV) x hjärtfrekvens (HR)) genom att helt enkelt ”ögonbollar” LV-klämma är en adekvat bedömning av läkare i akut miljö.27 I CS är den underlägsna vena cava (IVC), vilket är en indirekt mätning av effektiv intra vaskulär volym, bör ha en diameter på > 2 cm i diameter och kollapsar mindre än 50% med inspiration. Dessa resultat korrelerar med ett förhöjt centralt venöst tryck.28 IVC-bedömningen kan dock vara felaktig om patienten redan har fått vasodilatatorer, diuretika och / eller ventilerats.29 Thoraxfönster visar sannolikt lungödem i form av överdriven B linjer (”lungraketer”) som är resultatet av septalförtjockning från ackumulering av vatten i interstitiumet. 30 Tillsammans med lungträngsel kan det finnas pleural och peritoneal vätska vid RUSH-undersökningen.25 I en metaanalys som använde data från tre original RUSH-protokollet visade sig vara både känsligt och specifikt (0,89 respektive 0,97) vid diagnosen CS.31 Trots ett högt resulterande positivt sannolikhetsförhållande (LR) på 22,29 fanns det bara ett måttligt negativt LR på 0,17, vilket tyder på att RUSH-undersökningen inte är det perfekta testet för att utesluta CS. Därför bör RUSH-undersökningen användas i samband med en noggrann historia och fysisk undersökning snarare än att användas ensam för att diagnostisera kardiogeni c-chock.
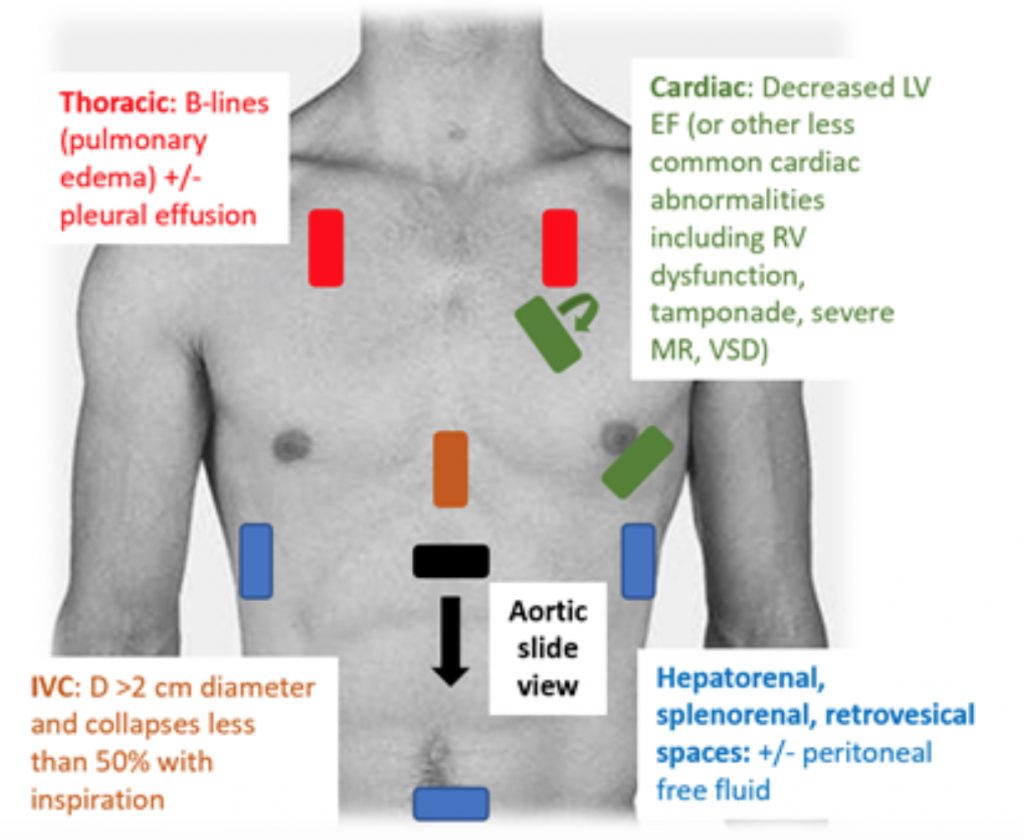
Figur 3: RUSH bedside US-undersökning för utvärdering av odifferentierad hypotoni med associerade resultat som tyder på CS.25 , 26,29,30
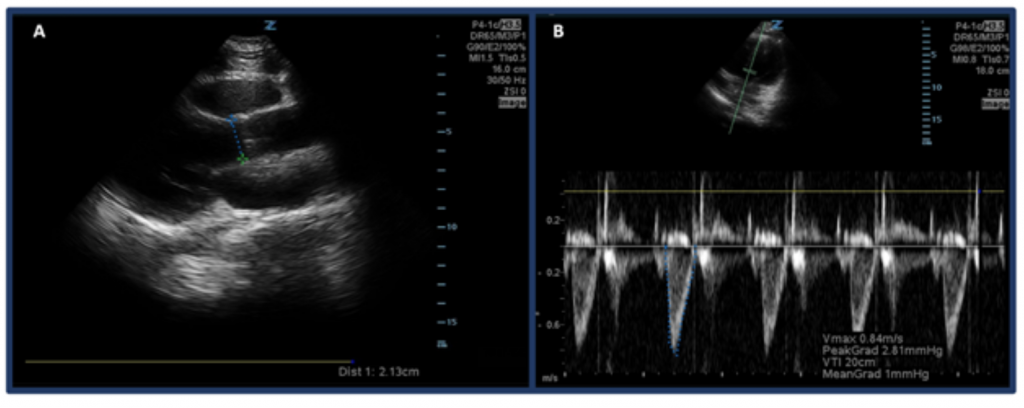
I stället för att bara uppskatta CO genom ”ögonglobning”, är ett sätt att mäta CO med ultraljud att först bestämma SV med hjälp av vänstra ventrikelns utflödeshastighets tidsintervall (LVOT VTI, eller hastigheterna blodflödet vid aortautflödeskanalen) och LVOT-diameter. Specifikt beräknas SV, eller mängden blod som matas ut genom vänster kammare per takt, av LVOT VTI × tvärsnittsarea av LVOT .32 För att mäta LVOT-diameter, placera den fasvisa array-sonden i den parasternala långaxelvyn och mäta avståndet för LVOT strax ovanför aortaklaffen medan du är i mitten av systolen. VTI mäts i vyn apikal-5-kammare. Med hjälp av dopplerläget för pulsvåg placeras dopplervågen strax ovanför aortaklaffen och dopplervågformer registreras. Var noga med att ställa in axeln så mycket som möjligt med utflödeskanalen för att undvika över / under uppskattningar. När du har valt ”LVOT VTI” -mätverktyg, mät vågformen för en utkastningsperiod. 33,34 Normal LVOT VTI sträcker sig från 18-22 cm, även om det är lägre med HRs > 95 bpm. 35 Hos patienter med förmaksflimmer kommer VTI-mätningar sannolikt att underskatta det verkliga värdet och därför föreslås i genomsnitt 3-5 på varandra följande vågformer. Som man kan förvänta sig finns det en korrelation mellan låg LVOT VTI och negativa resultat.32
Rekommenderad utvärderingsväg
Som diskuterats ovan finns det inte en enda undersökning eller laboratorietest som kan diagnostisera CS. Därför, när det finns en hög misstanke om CS i samband med hypotension eller tecken på hypoperfusion, föreslår vi att du använder historia, en detaljerad fysisk undersökning, bedside US, laboratorier (specifikt kreatinin, laktat, troponin, BNP och andra markörer för hypoperfusion / organskada) och EKG (som akut MI är den främsta orsaken till CS och tecken på ischemi och kan kräva framväxande revaskularisering) för att underlätta diagnosen (se figur 5). Tänk på en arteriell katetermonitor för BP och vägleda behandlingen. Utöver en fokuserad hjärt- och lungundersökning bör fysisk undersökning fokusera på JVD och extremitetsperfusion. RUSH-undersökningen och beräkningen av EF / CO / CI genom LVOT VTI-mätningar som diskuterats ovan är värdefulla komplement till utvärderingen. Att använda en omfattande metod för att utvärdera för CS kommer att skapa en bättre förståelse för denna heterogena sjukdom och hjälpa till att hantera hanteringen.
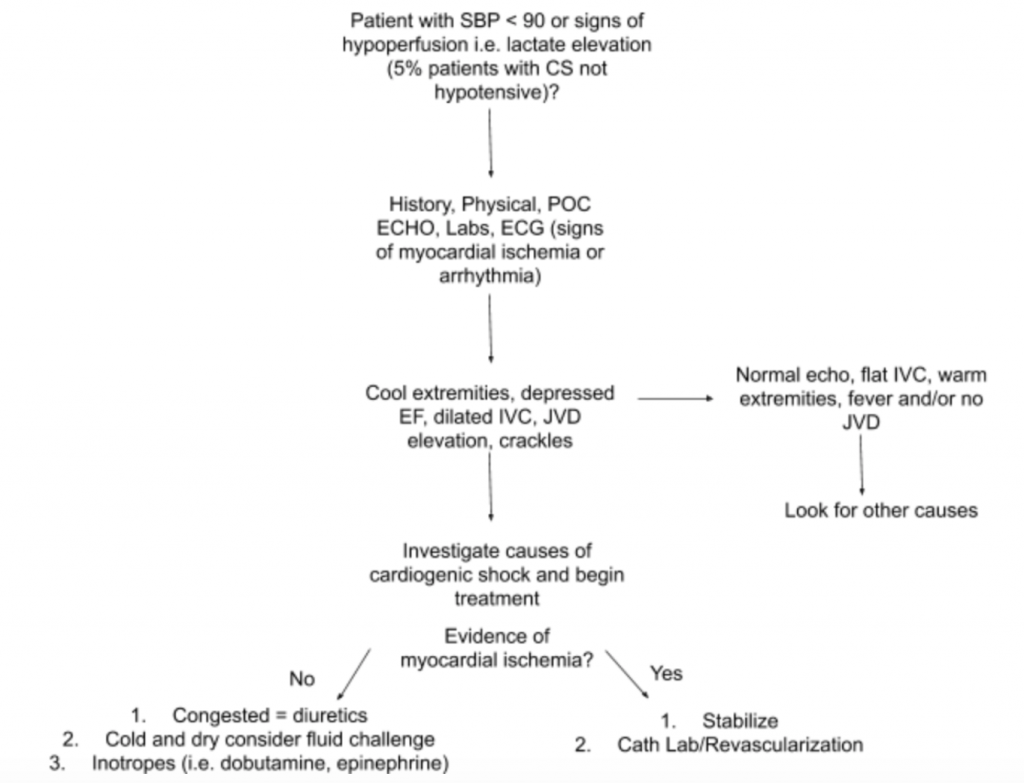
Fallens slutsats : Vid ytterligare utvärdering höjs patientens jugulära venösa tryck till 10 cmH20, och hans fötter är svala med fördröjd kapillärpåfyllning. RUSH-undersökning vid sängen visar bilateralt diffust lungödem och en uppskattad låg EF.LVOT VTI mäts endast 10 cm. EKG visar ST-höjder i de precordiala ledningarna. Laktat och troponin är lätt förhöjda. Patienten stabiliseras med en kort prövning av dobutamin, IV-furosemid och CPAP med måttlig förbättring av vitala och andningsstatus och skickas därefter till katlaboratoriet för framväxande PCI.
Ta hem poäng:
- CS orsakas främst av en akut MI (~ 70%) och är i fokus för de flesta studier men andra orsaker bör också övervägas (se fullständig lista i figur 1).
- Dödligheten sekundär till CS är fortsatt hög (~ 60%), även om tidig identifiering och intervention förbättrar överlevnaden.
- Utför en noggrann fysisk undersökning som letar efter hypoperfusion och trängsel. JVP är en viktig fysisk undersökningskomponent för diagnos av CS och är associerad med ökad dödlighet (RR = 1,52).
- RUSH-undersökningen är både känslig och specifik (0,89 respektive 0,97) vid diagnosen CS. Ultraljud vid sängkanten bör upprepas ofta, eftersom de flesta patienter inte initialt är närvarande i CS. En föreslagen metod för utvärdering av patienter med misstänkt CS med fokus på dess heterogena patologi och presentation sammanfattas i figur 5.
FOAMed Resources:
- EM i 5 : Shock
- emDocs: Cardiogenic Shock
- emDocs: ED Management of Heart Failure- Pearls and Fallfalls
- emDocs: RUSH (”Rapid Ultraljud för chock”) Protokoll
- emDocs: Den hypotensiva ED-patienten: En sekventiell systematisk metod
- Första 10 EM: Odifferentierad hypotension
