Caso: un uomo di 73 anni con una storia di ipertensione, malattia coronarica e precedente miocardico infarto (MI) si presenta al pronto soccorso (DE) con affaticamento, mancanza di respiro, diminuzione della produzione di urina e gonfiore alle caviglie. All’arrivo, i suoi segni vitali includono BP 87/58 mm Hg, HR 102, RR 24, saturazione T 86% nell’aria ambiente e temperatura 98,2 F, e ha crepitii all’auscultazione. Come gestireste questo paziente?
Che cos’è lo shock cardiogeno?
Anche se le definizioni variano, lo shock cardiogeno (CS) è una diagnosi clinica ampiamente definita come uno stato di bassa gittata cardiaca con associati perfusione d’organo inadeguata o ipoperfusione tissutale secondaria a danno cardiaco. 1 I criteri comunemente utilizzati derivati dallo studio SHOCK consistono in ipotensione (SBP < 90 mmHg o > 90 mmHg con terapia di supporto), evidenza di ipoperfusione d’organo e indice cardiaco (CI) < 2,2 L / min / m2 o pressione del cuneo capillare polmonare ≥ 15 mmHg 2,3 Sebbene questa definizione sia utile per standardizzare i criteri di inclusione per gli studi clinici , è meno utile per la diagnosi di CS nel dipartimento di emergenza (DE). Durante il turno in un ED occupato, la SC può essere difficile da diagnosticare a causa delle diverse presentazioni, della sovrapposizione con altri stati di shock (ad es. Sepsi), fisiopatologia poco conosciuta, cause complesse e multifattoriali e parametri emodinamici variabili.4 In assenza di gittata cardiaca invasiva (CO) e valori PCWP, CS possono essere dedotti utilizzando prove di pressioni di riempimento elevate (cioè congestione polmonare o JVP elevato), segni clinici di ipoperfusione e una storia ed eco suggestivi di insufficienza cardiaca. La mortalità secondaria a CS è alta (~ 25-70%), ma il riconoscimento e l’intervento precoci migliorano la sopravvivenza.4,5 I medici di emergenza hanno l’opportunità di diagnosticare la CS al momento del ricovero e devono mantenere un alto sospetto clinico quando vedono un paziente in condizioni critiche. Questa recensione si concentrerà sul riconoscimento e sui suggerimenti su come non perdere la diagnosi di CS attraverso esame fisico, laboratori, ecografia al posto letto e imaging.
Quali sono le cause dello shock cardiogeno?
La maggior parte degli studi sulla CS si concentra su pazienti con CS secondaria a infarto miocardico (IM) che coinvolge il ventricolo sinistro. Sebbene gli IM siano la causa principale di CS (~ 70%), qualsiasi causa di disfunzione ventricolare e CO ridotto o indice cardiaco (CO / area di superficie corporea) deve essere considerata come causa potenziale.6 Ciò include, ma non è limitato a, cause non ischemiche di insufficienza cardiaca destra, miocardite, cardiomiopatia da takotsubo, cardiomiopatia ipertrofica o cardiopatia valvolare (Tabella 1). Per rendere le cose più impegnative, la CS è un continuum piuttosto che uno stato statico, che va dal peggioramento dell’insufficienza cardiaca allo shock refrattario con danno irreversibile agli organi terminali (Figura 1). CS diventa ancora più variabile con il verificarsi di insulti secondari come aritmie o ischemia progressiva e acidosi.3 Va notato che in 2/3 dei casi, CS non è presente al ricovero ma si sviluppa successivamente entro 48 ore dal ricovero come paziente progredisce lungo il continuum dello shock.7 È importante rivalutare frequentemente i segni vitali, i sintomi, l’esame obiettivo e l’eco al letto del paziente.

Tabella 1: Cause di SC, adattato da Parrillo & Dellinger (2013) .8 Il 70% dei casi di SC è causato da IM acuti.6 Effetti di IM acuto con associato percentuali prese dai risultati del registro dello studio SHOCK. 9.10
Figura 1: Continuum di CS, adattato da Bellumkonda et al . (2018) .3 Questo spettro può deviare con insulti secondari (es. Nuove aritmie).
Mortalità nello shock cardiogeno
Sebbene la mortalità secondaria a CS rimanga alta, 4 riconoscimento e intervento precoci migliora la sopravvivenza.5 Utilizzando i dati che includevano il registro dello studio SHOCK, la mortalità in ospedale a 30 giorni di 1.217 pazienti a cui era stata diagnosticata una CS secondaria a insufficienza del ventricolo sinistro (LV) o del ventricolo destro (RV) a causa di un IM acuto era del 57% . Se si prendono in considerazione diversi fattori di rischio, in particolare shock al ricovero, età, precedente bypass aorto-coronarico (CABG), IM non inferiore, creatinina > 1,9 mg / dL, SBP ridotta, anossica lesioni cerebrali e prove cliniche di ipoperfusione di organi terminali, i pazienti potrebbero essere suddivisi con mortalità compresa tra 12% e 88% .11 Nello studio GRACE, la CS è diminuita debolmente ma significativamente tra il 1999 e il 2006, probabilmente a causa dell’aumento dell’uso intervento coronarico (PCI), un’importante forma di intervento precoce per i pazienti con IM complicato da CS.12 Anche quando si stratificano i pazienti in base ai fattori di rischio, PCI e CABG hanno portato benefici sia ai pazienti a basso che ad alto rischio.11 La diagnosi precoce e il trattamento appropriato rimangono, in particolare nel caso dell’ischemia miocardica, un importante contributo modificabile agli esiti per i pazienti con CS.
Inoltre, più a lungo la CS progredisce, più è probabile che ci sarà un infiammatorio disadattivo. risposta secondaria ad un aumento delle citochine come TNF-alfa e IL-6, che inibiscono l’attività cardiaca. 4,13 C’è anche un aumento della vasopressina e dell’angiotensina II, che aumenta il postcarico, peggiora la CO e aumenta la ritenzione di acqua e sale, causando così edema polmonare. L’ossido nitrico (NO) è anche aumentato attraverso l’attivazione di NO sintasi, portando a vasodilatazione e depressione miocardica. Tutte queste risposte disadattive alla bassa CO e all’ischemia miocardica portano a un peggioramento del danno al tessuto cardiaco, a una riduzione della CO e allo shock distributivo. Va notato che alcuni casi di CS sono iatrogeni, quando i pazienti sull’orlo dello scompenso cardiaco sono trattati con diuretici aggressivi, nitrati, beta bloccanti, ACEI e morfina. 14 Pertanto, in qualità di primo medico a valutare i pazienti, i medici di emergenza devono identificare e trattare la CS in modo sensibile al tempo e clinicamente appropriato.
Valutazione clinica
Classicamente, i pazienti con CS presentarsi con lamentele di dispnea, dolore toracico, affaticamento e / o gonfiore alle caviglie.15 L’esame fisico può rivelare segni di congestione inclusi edema periferico, distensione della venosa giugulare (JVD), crepitii / rantoli all’auscultazione e segni di ipoperfusione come raffreddore, estremità scarsamente perfuse (Tabella 2). In una piccola revisione retrospettiva di 30 pazienti in shock indifferenziato, quelli con CS avevano maggiori probabilità di avere JVD (80% rispetto a 0% e 20%), pelle fredda (57,1% rispetto a 14,3% e. 28,5%) e polmonare rantoli (75% vs 16,7% e 8,3%) rispetto ai pazienti con shock distributivo e ipovolemico, rispettivamente.16 In un altro studio prospettico con 68 pazienti, i residenti hanno utilizzato risultati di esami clinici specifici per differenziare le categorie di shock. CS è stato classificato da SBP inferiore a 90, segni di bassa emissione (mani fredde, scarsa ricarica capillare e polso debole), pressione venosa giugulare elevata (JVP) > 7 cmH2O, S3 galoppo e crepita a 1/3 dei polmoni. Di 68 pazienti, 11 soddisfacevano i criteri per la CS. Nei pazienti con evidenza ecocardiografica di bassa gittata cardiaca, una JVP elevata ha predetto CS con una precisione dell’80%, che è rimasta invariata quando si aggiunge la presenza di crepitii.17
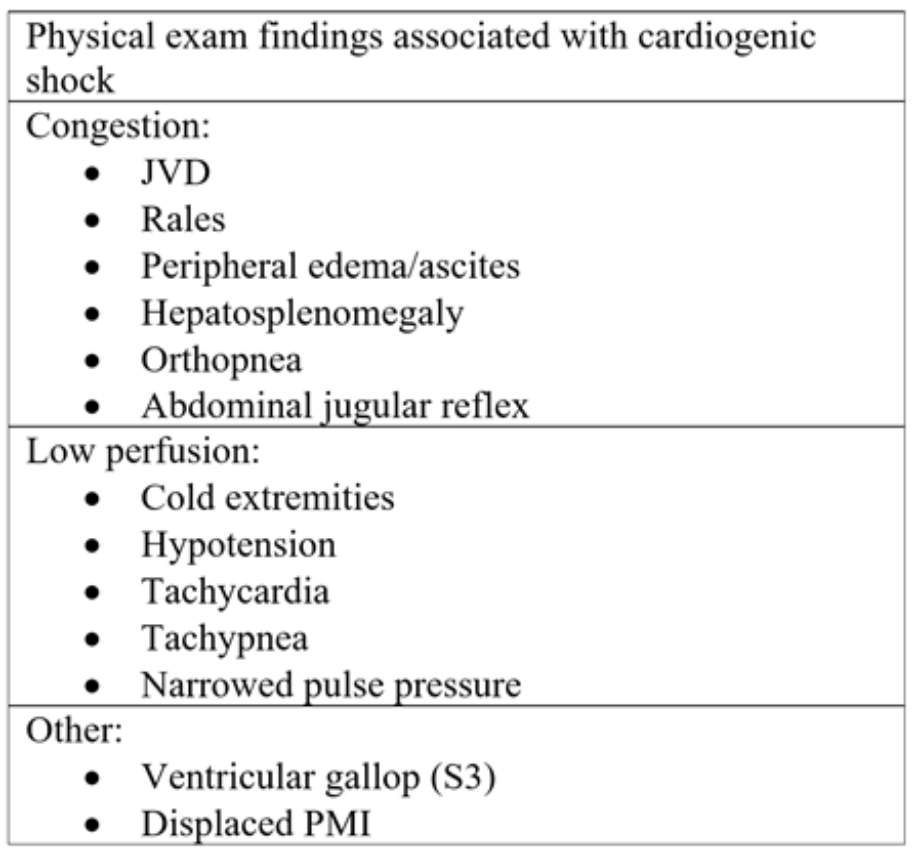
Tabella 2: componenti dell’esame fisico osservati nell’insufficienza cardiaca acuta e conseguente shock cardiogeno.18
Sebbene JVP sia un utile indicatore per pressioni di cuneo elevate 19, può essere difficile da valutare a causa dell’habitus corporeo e del posizionamento del paziente (la testa del letto deve essere sollevata di 45 gradi, il che può essere difficile nei pazienti con ortopnea grave) .20 La JVP viene misurata calcolando il punto di pulsazione più alto in cm sopra l’angolo sternale e quindi aggiungere 5 (poiché l’atrio destro è 5 cm sotto l’angolo sternale), che è correlato alla distensione in cmH20 (Figura 2). I valori elevati sono spesso considerati maggiori di 6-8 cmH20.18 Da notare, un JVP elevato è associato a un aumento del rischio di mortalità, con un rischio relativo (RR) di 1.52.18
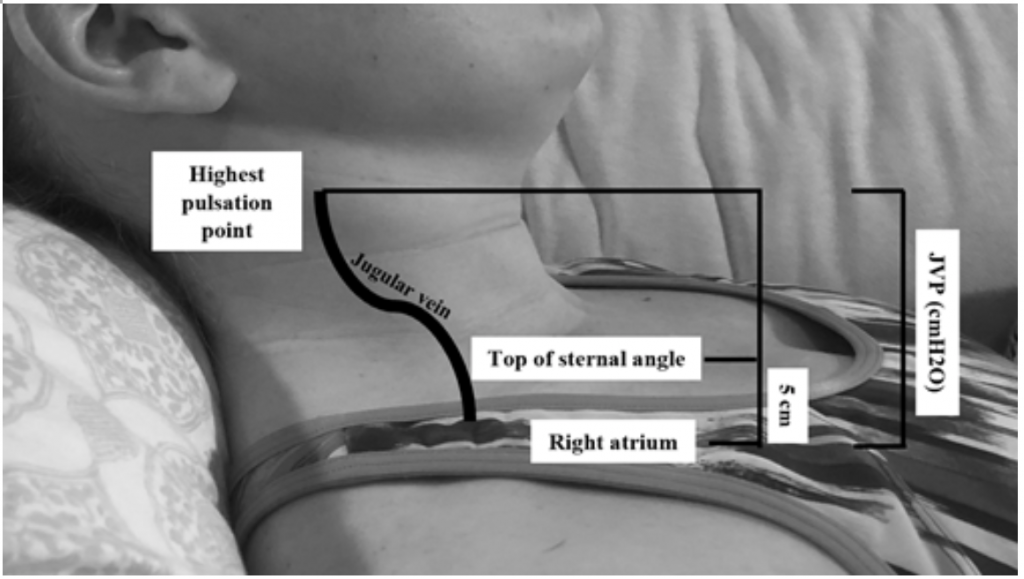
Figura 2: Measuring JVP, adattato da Shah & Cowger (2014) .18
Labs può mostrare un’acidosi metabolica (quando il lattato aumenta a causa dell’ischemia periferica), ipoperfusione renale con conseguente danno renale acuto e possibile evidenza di ischemia cardiaca con troponina elevata ed alterazioni dell’ECG.15 Nello studio CardShock, uno studio multicentrico, prospettico, osservazionale di 219 CS pazienti, i livelli di lattato erano significativamente associati a un aumento della mortalità (odds ratio aggiustato di 1,4) .6 È importante notare che l’aumento del lattato non è specifico della sepsi e può essere visto in qualsiasi stato di ipoperfusione come CS.
D’altra parte, questi risultati dell’esame fisico e parametri emodinamici non sono sempre validi. In uno studio che utilizzava il registro dello SHOCK Trial, il 5,2% dei pazienti con CS non presentava ipotensione manifesta sebbene presentasse segni di ipoperfusione periferica e un basso CI.21 Ciò è probabilmente dovuto a un rilascio adattativo di catecolamine all’inizio della CS, che aumenta la resistenza vascolare sistemica ( SVR) e mantiene temporaneamente la pressione sanguigna, sebbene generalmente con una pressione del polso ridotta.22 Anche i pazienti con edema polmonare clinicamente significativo all’imaging possono presentare sibili o persino suoni polmonari chiari piuttosto che rantoli.23 In uno studio, la congestione polmonare è stata osservata solo in circa 2/3 casi di CS secondario a IM.21 Inoltre, anche con una ridotta contrattilità del VS, i pazienti con CS potrebbero non avere una grave riduzione della LVEF. 14,24 In effetti, la EF media in una coorte di pazienti con CS è di circa il 30%, che è ridotta ma superiore al previsto.2
Sebbene l’esame non sia perfetto, un esame fisico dettagliato alla ricerca di segni di congestione e ipoperfusione periferica insieme a un’attenta revisione dei segni vitali e dei laboratori potrebbe essere il primo indizio che il tuo paziente ha uno shock cardiogeno.
ECHO point-of-care per la valutazione dello shock cardiogeno
Quando i pazienti si presentano al DE ipotensivo o ipoperfuso, l’esame RUSH è un modo rapido per differenziare lo shock guardando “la pompa, il serbatoio e le tubature. “25,26 Per CS, l’ecocardiogramma transtoracico mostra classicamente un VS ipodinamico, dilatato, con scarsa compressione del VS e movimento inadeguato associato del lembo anteriore della valvola mitrale durante la sistole e la diastole (cioè scarsa contrattilità). La stima della frazione di eiezione (EF) e della CO (come CO = volume sistolico (SV) x frequenza cardiaca (HR)) attraverso la semplice compressione del ventricolo sinistro “bulbo oculare” è una valutazione adeguata da parte dei medici in ambito acuto.27 Nella CS, la vena inferiore cava (IVC), che è una misura indiretta di intra efficace volume vascolare, dovrebbe avere un diametro di > 2 cm di diametro e collassare meno del 50% con l’inspirazione. Questi risultati sono correlati a una pressione venosa centrale elevata.28 Tuttavia, la valutazione della IVC può essere imprecisa se il paziente ha già ricevuto vasodilatatori, diuretici e / o è ventilato.29 È probabile che le finestre toraciche mostrino edema polmonare sotto forma di B eccessivo linee (“razzi polmonari”) che sono il risultato dell’ispessimento del setto dovuto all’accumulo di acqua nell’interstizio.30 Insieme alla congestione polmonare, potrebbe esserci fluido pleurico e peritoneale all’esame RUSH.25 In una meta-analisi che ha utilizzato i dati di tre documenti e due case report, il protocollo RUSH ha dimostrato di essere sia sensibile che specifico (0,89 e 0,97, rispettivamente) nella diagnosi di CS.31 Nonostante un elevato rapporto di probabilità positivo (LR) di 22,29, c’era solo un moderato negativo LR di 0,17, suggerendo che l’esame RUSH non è il test perfetto per escludere CS. Pertanto, l’esame RUSH dovrebbe essere utilizzato nel contesto di un’attenta anamnesi e di un esame fisico piuttosto che usato da solo per diagnosticare cardiogeni c shock.
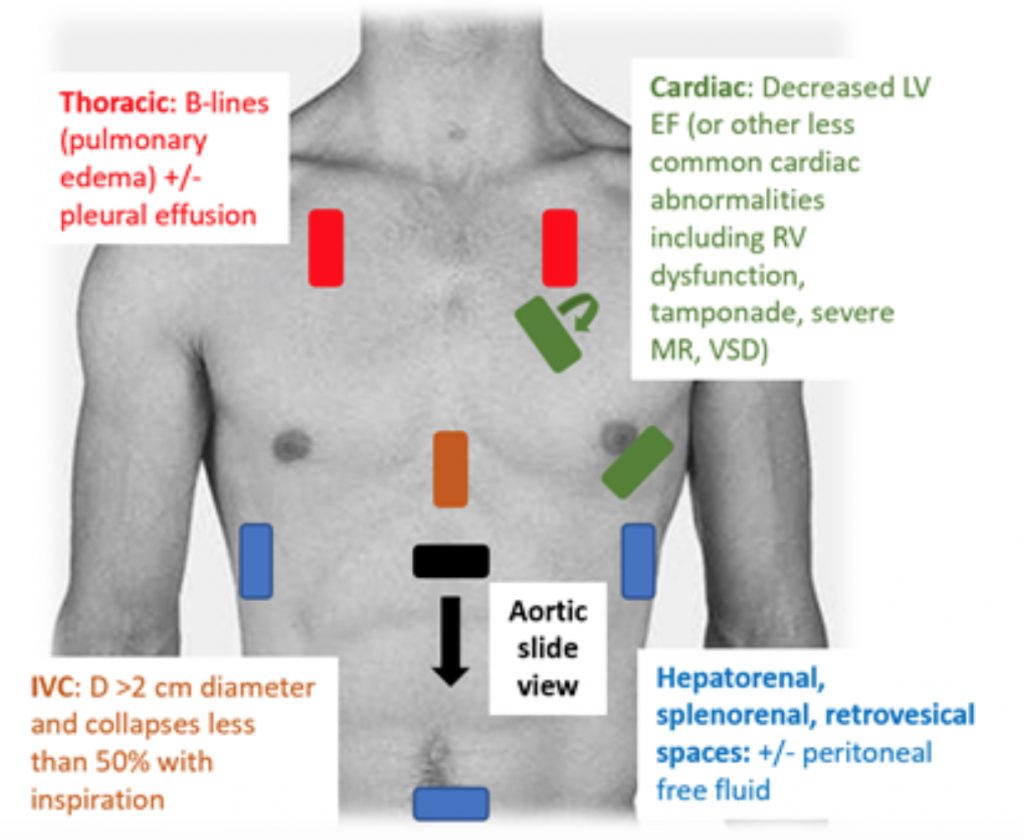
Figura 3: Esame americano RUSH al posto letto per la valutazione dell’ipotensione indifferenziata con risultati associati suggestivi di CS.25 , 26,29,30
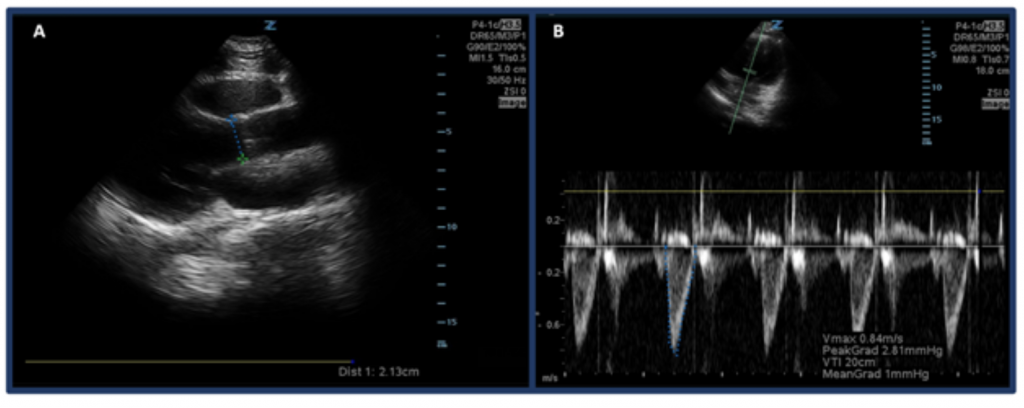
Piuttosto che stimare la CO attraverso “il bulbo oculare”, un modo per misurare la CO con gli ultrasuoni consiste nel determinare prima la SV utilizzando l’intervallo di tempo della velocità del tratto di efflusso ventricolare sinistro (LVOT VTI, o le velocità di flusso sanguigno al tratto di deflusso aortico) e diametro LVOT. In particolare, SV, o la quantità di sangue espulso attraverso il ventricolo sinistro per battito, è calcolato da LVOT VTI × area della sezione trasversale del LVOT .32 Per misurare il diametro del LVOT, posizionare la sonda phased array nella vista dell’asse lungo parasternale e misurare il distanza dell’LVOT appena sopra la valvola aortica a metà sistole. La VTI viene misurata nella vista apicale a 5 camere. Utilizzando la modalità doppler a onda pulsata, l’onda doppler viene posizionata appena sopra la valvola aortica e le forme d’onda doppler vengono registrate. Assicurati di allineare l’asse con il tratto di deflusso nel miglior modo possibile per evitare stime eccessive / inferiori. Dopo aver selezionato lo strumento di misurazione “LVOT VTI”, misurare la forma d’onda di un periodo di espulsione.33,34 LVOT VTI normale varia da 18-22 cm, anche se possibilmente inferiore con FC > 95 bpm. 35 Nei pazienti con fibrillazione atriale, le misurazioni di VTI saranno probabilmente una sottostima del valore reale, e quindi si suggerisce di fare una media di 3-5 forme d’onda consecutive. Come ci si aspetterebbe, esiste una correlazione tra LVOT VTI basso e esiti avversi.32
Percorso di valutazione consigliato
Come discusso in precedenza, non esiste un singolo esame o test di laboratorio in grado di diagnosticare CS. Pertanto, quando vi è un alto sospetto di CS in un contesto di ipotensione o segni di ipoperfusione, suggeriamo di utilizzare la storia, un esame fisico dettagliato, US al posto letto, laboratori (in particolare creatinina, lattato, troponina, BNP e altri marcatori di ipoperfusione / danno d’organo) ed ECG (poiché l’IM acuto è la causa primaria di CS e segni di ischemia e può richiedere rivascolarizzazione) per aiutare nella diagnosi (vedere la Figura 5). Considerare un monitor con catetere arterioso per la PA e guidare il trattamento. Oltre a un esame cardiaco e polmonare mirato, l’esame obiettivo dovrebbe concentrarsi sulla JVD e sulla perfusione degli arti. L’esame RUSH e il calcolo di EF / CO / CI tramite le misurazioni LVOT VTI discussi sopra sono utili aggiunte alla valutazione. L’utilizzo di un approccio completo per la valutazione della CS creerà una migliore comprensione di questa malattia eterogenea e aiuterà a guidare la gestione.
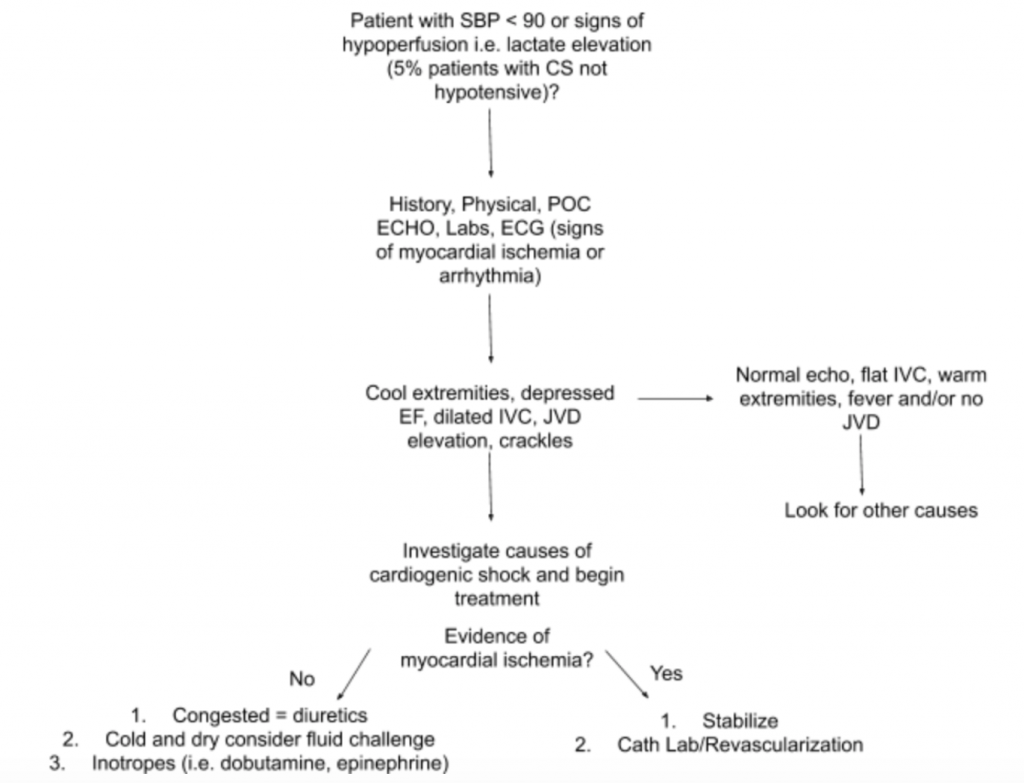
Conclusione del caso : Ad un’ulteriore valutazione, la pressione venosa giugulare del paziente viene aumentata a 10 cmH20 ei suoi piedi sono freddi con il riempimento capillare ritardato. L’esame RUSH al posto letto mostra un edema polmonare diffuso bilaterale e una EF bassa stimata.LVOT VTI è misurato a soli 10 cm. L’ECG mostra elevazioni ST nelle derivazioni precordiali. Il lattato e la troponina sono leggermente elevati. Il paziente viene stabilizzato con una breve prova di dobutamina, furosemide EV e CPAP con un miglioramento moderato in vitali e stato respiratorio, e successivamente inviato al laboratorio di cateterismo per PCI emergente.
Porta a casa i punti:
- La CS è principalmente causata da un IM acuto (~ 70%) ed è al centro della maggior parte degli studi, ma dovrebbero essere considerate anche altre cause (vedere elenco completo nella Figura 1).
- La mortalità secondaria a SC rimane alta (~ 60%), sebbene l’identificazione precoce e l’intervento migliori la sopravvivenza.
- Eseguire un attento esame fisico alla ricerca di ipoperfusione e congestione. La JVP è una componente importante dell’esame fisico per la diagnosi di CS ed è associata ad un aumento della mortalità (RR = 1,52).
- L’esame RUSH è sia sensibile che specifico (0,89 e 0,97, rispettivamente) nella diagnosi di CS. L’ecografia al letto del paziente deve essere ripetuta frequentemente poiché la maggior parte dei pazienti non si presenta inizialmente in CS.
- L’uso di LVOT VTI è un metodo semplice e non invasivo per valutare la CO con basse misurazioni associate a esiti avversi.
- Un approccio suggerito per valutare i pazienti con sospetta SC con particolare attenzione alla sua patologia e presentazione eterogenea è riassunto nella Figura 5.
Risorse FOAM:
- EM in 5 : Shock
- emDocs: Shock cardiogenico
- emDocs: ED Management of Heart Failure – Pearls and Trafalls
- emDocs: RUSH (“Rapid Ultrasound for Shock”) Protocol
- emDocs: The Hypotensive ED Patient: A Sequential Systematic Approach
- First 10 EM: Undifferentiated Hypotension
