Casus: een 73-jarige man met een voorgeschiedenis van hypertensie, coronaire hartziekte en eerdere myocardiale infarct (MI) presenteert zich op de afdeling spoedeisende hulp (ED) met vermoeidheid, kortademigheid, verminderde urineproductie en zwelling van de enkel. Bij aankomst omvatten zijn vitale functies BP 87/58 mm Hg, HR 102, RR 24, T-verzadiging 86% op kamerlucht en temperatuur 98,2 F, en hij heeft gekraak bij auscultatie. Hoe zou u deze patiënt behandelen?
Wat is cardiogene shock?
Hoewel de definities variëren, is cardiogene shock (CS) een klinische diagnose die breed wordt gedefinieerd als een toestand van laag hartminuutvolume met bijbehorende onvoldoende doorbloeding van het eindorgaan of hypoperfusie van het weefsel als gevolg van hartbeschadiging. 1 Veelgebruikte criteria afgeleid van de SHOCK-studie zijn hypotensie (SBP < 90 mmHg of > 90 mmHg met ondersteunende zorg), bewijs van orgaanhypoperfusie en cardiale index (BI) < 2,2 l / min / m2 of pulmonale capillaire wiggedruk ≥ 15 mmHg 2,3 Hoewel deze definitie nuttig is om inclusiecriteria voor klinische onderzoeken te standaardiseren , is het minder waardevol voor het diagnosticeren van CS op de afdeling spoedeisende hulp (ED). In een drukke spoedeisende hulp kan CS een uitdaging zijn om een diagnose te stellen vanwege de diverse presentaties, overlapping met andere shocktoestanden (bijv. Sepsis), slecht begrepen pathofysiologie, complexe en multifactoriële oorzaken en gevarieerde hemodynamische parameters.4 Bij afwezigheid van invasieve cardiale output (CO) en PCWP-waarden, CS kan worden afgeleid met behulp van bewijs van verhoogde vullingsdrukken (dwz pulmonale congestie of verhoogde JVP), klinische tekenen van hypoperfusie en een geschiedenis en echo die wijzen op hartfalen. Sterfte secundair aan CS is hoog (~ 25-70%), maar vroege herkenning en interventie verbetert de overleving.4,5 Spoedeisende artsen hebben de mogelijkheid om CS bij opname te diagnosticeren en moeten een hoog klinisch vermoeden behouden bij het zien van een ernstig zieke patiënt. Deze recensie zal zich richten op herkenning en tips om de diagnose van CS niet te missen door middel van lichamelijk onderzoek, labs, echografie aan het bed en beeldvorming.
Wat zijn de oorzaken van cardiogene shock?
De meeste onderzoeken naar CS zijn gericht op patiënten met CS secundair aan myocardinfarct (MI’s) waarbij het linkerventrikel betrokken is. Hoewel MI’s de primaire oorzaak van CS zijn (~ 70%), moet elke oorzaak van ventriculaire disfunctie en verminderde CO of cardiale index (CO / lichaamsoppervlak) als mogelijke oorzaak worden overwogen.6 Dit omvat, maar is niet beperkt tot, niet-ischemische oorzaken van rechterhartfalen, myocarditis, takotsubo-cardiomyopathie, hypertrofische cardiomyopathie of hartklepaandoening (tabel 1). Om het nog uitdagender te maken, is CS een continuüm in plaats van een statische toestand, variërend van verergering van hartfalen tot refractaire shock met onomkeerbare schade aan het eindorgaan (Figuur 1). CS wordt nog variabeler met het optreden van secundaire insulten zoals aritmieën of progressieve ischemie en acidose.3 Opgemerkt moet worden dat in 2/3 van de gevallen CS niet aanwezig is bij opname, maar zich later binnen 48 uur na ziekenhuisopname ontwikkelt als patiënt vordert langs het continuüm van shock.7 Het is belangrijk om de vitale functies, symptomen, lichamelijk onderzoek en echo bij het bed van patiënten regelmatig opnieuw te evalueren.

Tabel 1: Oorzaken van CS, aangepast van Parrillo & Dellinger (2013) .8 70% van de CS-gevallen wordt veroorzaakt door acute MI’s.6 Effecten van acute MI met bijbehorende percentages uit de resultaten van de SHOCK-trialregistratie 9.10
Figuur 1: Continuum van CS, aangepast van Bellumkonda et al. . (2018) .3 Dit spectrum kan afwijken bij secundaire beledigingen (bijv. Nieuwe aritmieën).
Sterfte bij cardiogene shock
Hoewel de sterfte secundair aan CS hoog blijft, 4 vroege herkenning en interventie verbetert de overleving.5 Met behulp van gegevens die het SHOCK-onderzoeksregister omvatten, bedroeg de 30-daagse ziekenhuissterfte van 1.217 patiënten bij wie de diagnose CS secundair aan linkerventrikel (LV) of rechterventrikel (RV) falen als gevolg van een acuut myocardinfarct was gesteld 57% . Als u rekening houdt met verschillende risicofactoren, met name shock bij opname, leeftijd, eerdere coronaire bypass-transplantatie (CABG), niet-inferieur MI, creatinine > 1,9 mg / dL, verminderde SBP, anoxische hersenletsel en klinisch bewijs van hypoperfusie van het eindorgaan, konden patiënten worden onderverdeeld met mortaliteit variërend van 12% tot 88% .11 In de GRACE-studie nam CS zwak maar significant af tussen 1999 en 2006, waarschijnlijk als gevolg van het toegenomen gebruik van percutane coronaire interventie (PCI), een belangrijke vorm van vroege interventie voor patiënten met MI gecompliceerd door CS.12 Zelfs wanneer patiënten worden gestratificeerd op basis van risicofactoren, profiteerden PCI en CABG van zowel laag- als hoogrisicopatiënten.11 Vroege diagnose en passende behandeling blijven, met name in het geval van myocardischemie, een belangrijke bepaalbare bijdrage leveren aan de resultaten voor patiënten met CS.
Bovendien, hoe langer CS vordert, hoe groter de kans dat er een onaangepaste inflammatoire aandoening zal zijn. respons secundair aan een toename van cytokinen zoals TNF-alfa en IL-6, die de hartactiviteit remmen. 4,13 Er is ook een toename van vasopressine en angiotensine II, waardoor de afterload toeneemt, CO verergert en het vasthouden van water en zout toeneemt, waardoor longoedeem ontstaat. Stikstofmonoxide (NO) wordt ook verhoogd door de activering van NO-synthase, wat leidt tot vaatverwijding en myocardiale depressie. Al deze onaangepaste reacties op lage CO en myocardischemie leiden tot verslechtering van hartweefselschade, depressieve CO en distributieve shock. Opgemerkt moet worden dat sommige gevallen van CS iatrogeen zijn, wanneer patiënten die op het punt staan hartfalen te krijgen, worden behandeld met agressieve diuretica, nitraten, bètablokkers, ACE-remmers en morfine. 14 Daarom moeten spoedartsen, als eerste arts die patiënten evalueert, CS op een tijdgevoelige en klinisch geschikte manier identificeren en behandelen.
Klinische evaluatie
Klassiek, patiënten met CS aanwezig met klachten van dyspneu, pijn op de borst, vermoeidheid en / of gezwollen enkels.15 Lichamelijk onderzoek kan tekenen van congestie aan het licht brengen, waaronder perifeer oedeem, jugulaire veneuze distensie (JVD), gekraak / rales bij auscultatie en tekenen van hypoperfusie zoals koel, slecht doorbloede extremiteiten (tabel 2). In een kleine retrospectieve review van 30 patiënten met ongedifferentieerde shock, hadden degenen met CS meer kans op JVD (80% vergeleken met 0% en 20%), koude huid (57,1% vergeleken met 14,3% en 28,5%) en pulmonale rales (75% versus 16,7% en 8,3%) vergeleken met patiënten met respectievelijk distributieve en hypovolemische shock.16 In een andere prospectieve studie met 68 patiënten gebruikten bewoners specifieke bevindingen van klinisch onderzoek om categorieën van shock te onderscheiden. CS werd gecategoriseerd door SBP minder dan 90, tekenen van lage output (koude handen, slechte capillaire vulling en zwakke pols), verhoogde jugulaire veneuze druk (JVP) > 7 cm H2O, S3 galop , en knettert tot 1/3 van de longen. Van 68 patiënten voldeden 11 aan de criteria voor CS. Bij patiënten met echocardiografisch bewijs van een laag hartminuutvolume, voorspelde een verhoogde JVP CS met een nauwkeurigheid van 80%, wat onveranderd bleef bij het toevoegen van de aanwezigheid van craquelé.17
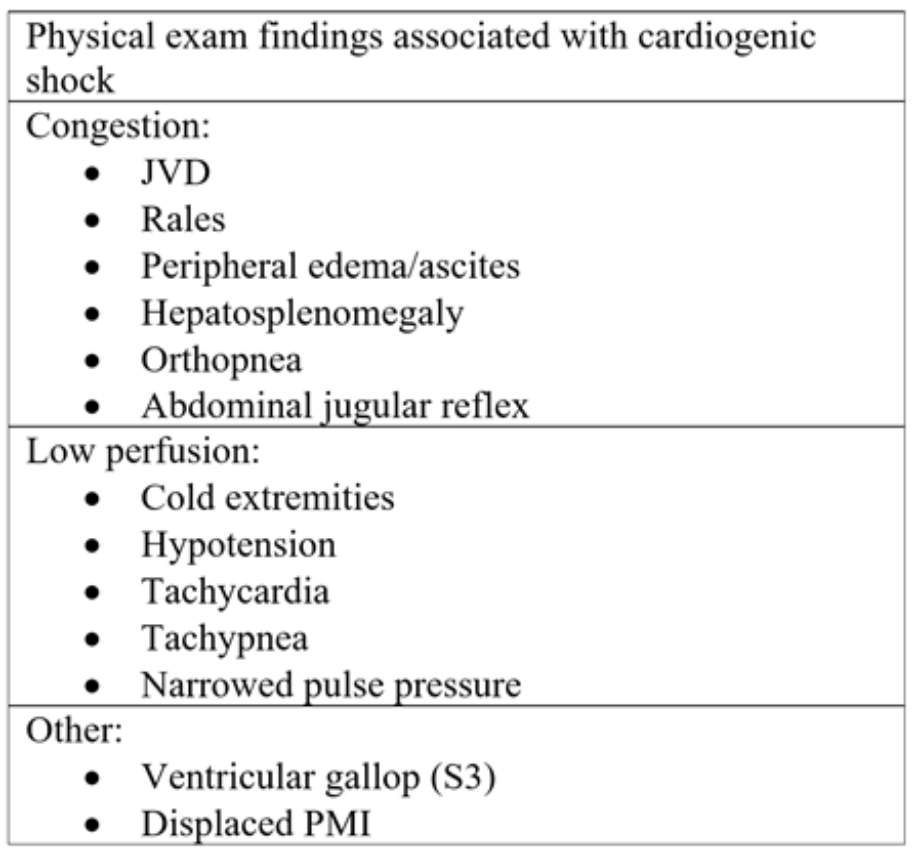
Tabel 2: Onderdelen van lichamelijk onderzoek bij acuut hartfalen en daaropvolgende cardiogene shock.18
Hoewel JVP een nuttige proxy is voor verhoogde wiggedruk 19, kan het moeilijk zijn om te beoordelen vanwege de lichaamshouding en positionering van de patiënt (het hoofdeinde van het bed moet 45 graden worden verhoogd, wat moeilijk kan zijn bij patiënten met ernstige orthopneu) .20 JVP wordt gemeten door het hoogste pulsatiepunt in cm boven de sternale hoek te berekenen en vervolgens 5 (aangezien het rechter atrium 5 cm onder de sternale hoek ligt), wat overeenkomt met distensie in cmH20 (Figuur 2). Verhoogde waarden worden vaak beschouwd als groter dan 6-8 cmH20.18 Merk op dat een verhoogde JVP wordt geassocieerd met een verhoogd risico op mortaliteit, met een relatief risico (RR) van 1.52.18
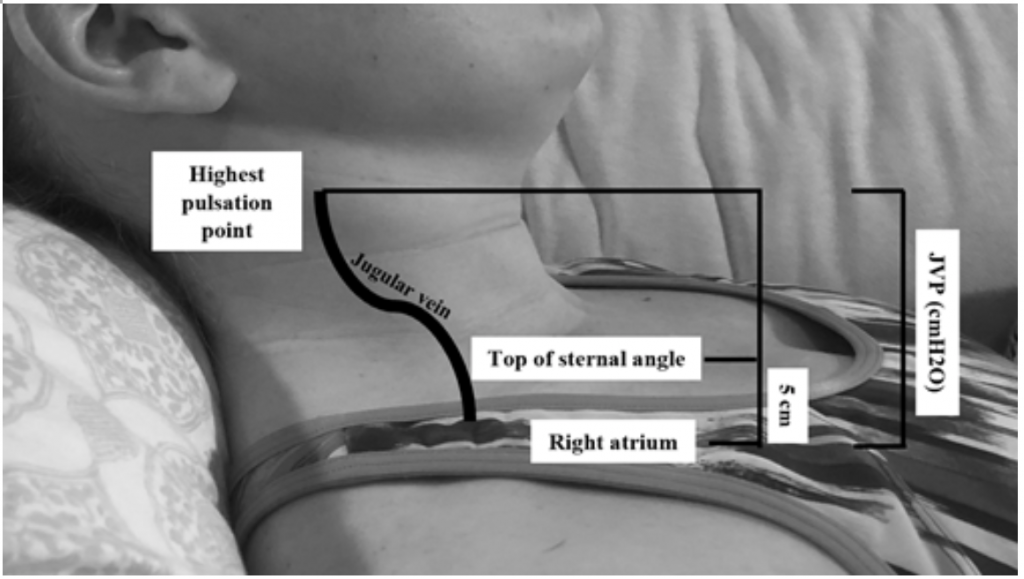
Figuur 2: JVP meten, aangepast van Shah & Cowger (2014) .18
Labs kan laten zien een metabole acidose (zoals lactaatverhoging als gevolg van perifere ischemie), nierhypoperfusie met als gevolg acuut nierletsel en mogelijk bewijs van cardiale ischemie met verhoogde troponine- en ECG-veranderingen.15 In de CardShock-studie werd een prospectieve, observationele studie in meerdere centra van 219 CS patiënten waren lactaatspiegels significant geassocieerd met verhoogde mortaliteit (gecorrigeerde odds ratio van 1,4) .6 Het is belangrijk op te merken dat lactaatverhoging niet specifiek is voor sepsis en kan worden gezien in elke hypoperfusietoestand zoals CS.
Aan de andere kant zijn deze bevindingen van lichamelijk onderzoek en hemodynamische parameters niet altijd waar. In een studie met behulp van het SHOCK Trial-register had 5,2% van de CS-patiënten geen duidelijke hypotensie, hoewel ze wel tekenen van perifere hypoperfusie en een laag BI vertoonden.21 Dit is waarschijnlijk te wijten aan een adaptieve catecholamine-afgifte in vroege CS, die de systemische vasculaire weerstand verhoogt SVR) en handhaaft tijdelijk de bloeddruk, hoewel over het algemeen met een smalle polsdruk.22 Zelfs patiënten met klinisch significant longoedeem bij beeldvorming kunnen piepende ademhaling of zelfs duidelijke longgeluiden vertonen in plaats van reanimatie.23 In één onderzoek werd pulmonale congestie alleen waargenomen bij ongeveer 2/3 gevallen van CS secundair aan MI.21 Bovendien is het mogelijk dat CS-patiënten, zelfs met verminderde LV-contractiliteit, geen ernstige verlaging van de LVEF hebben. 14,24 In feite is de gemiddelde EF in een cohort van CS-patiënten ongeveer 30%, wat lager is maar hoger dan verwacht.2
Hoewel het onderzoek niet perfect is, kan een gedetailleerd lichamelijk onderzoek waarbij wordt gezocht naar tekenen van congestie en perifere hypoperfusie, samen met een zorgvuldige beoordeling van vitale functies en laboratoria, de eerste aanwijzing zijn dat uw patiënt een cardiogene shock heeft.
Point-of-care ECHO voor het evalueren van cardiogene shock
Wanneer patiënten hypotensief of hypoperfuseerd zijn, is het RUSH-onderzoek een snelle manier om shock te onderscheiden door naar de ‘pomp, de tank en de leidingen. ”25,26 Voor CS toont transthoracaal echocardiogram klassiek een hypodynamische, verwijde LV, met slechte LV-squeeze en daarmee samenhangende onvoldoende beweging van het voorste klepblad van de mitralisklep tijdens systole en diastole (dwz slechte contractiliteit). Schatting van ejectiefractie (EF) en CO (als CO = slagvolume (SV) x hartfrequentie (HR)) door simpelweg ‘eyeballing’ LV-squeeze is een adequate beoordeling door artsen in de acute setting.27 Bij CS is de inferieure vena cava (IVC), wat een indirecte meting is van effectieve intra vasculair volume, moet een diameter hebben van > 2 cm diameter en stort minder dan 50% in bij inademing. Deze bevindingen correleren met een verhoogde centraal veneuze druk.28 De IVC-beoordeling kan echter onnauwkeurig zijn als de patiënt al vasodilatatoren, diuretica heeft gekregen en / of wordt beademd.29 Thoracale ramen vertonen waarschijnlijk longoedeem in de vorm van overmatige B lijnen (“longraketten”) die het resultaat zijn van septumverdikking door waterophoping in het interstitium.30 Naast longcongestie kan er pleuraal en peritoneaal vocht aanwezig zijn op het RUSH-onderzoek.25 In een meta-analyse die gegevens van drie originele documenten en twee casusrapporten, bleek het RUSH-protocol zowel gevoelig als specifiek (respectievelijk 0,89 en 0,97) te zijn bij de diagnose van CS.31 Ondanks een hoge resulterende positieve waarschijnlijkheidsratio (LR) van 22,29, was er slechts een matige negatieve LR van 0,17, wat suggereert dat het RUSH-examen niet de perfecte test is om CS uit te sluiten. Daarom moet het RUSH-examen worden gebruikt in de context van een zorgvuldige geschiedenis en lichamelijk onderzoek in plaats van alleen te worden gebruikt om cardiogenen te diagnosticeren. c shock.
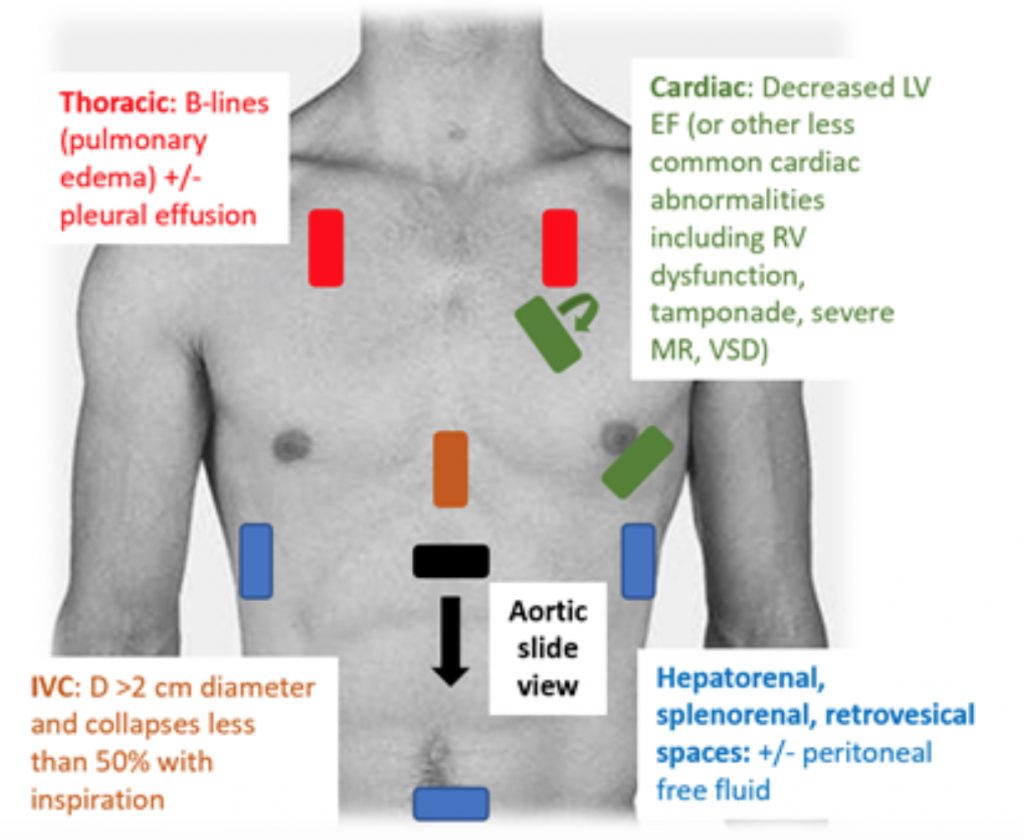
Figuur 3: RUSH US-onderzoek aan het bed voor de evaluatie van ongedifferentieerde hypotensie met bijbehorende bevindingen die wijzen op CS.25 , 26,29,30
In plaats van alleen CO te schatten door middel van ‘eyeballing’, is een manier om CO met echografie te meten, door eerst SV te bepalen met behulp van het snelheidsinterval van het linker ventrikel uitstroomkanaal (LVOT VTI, of de snelheden van de bloedstroom in het aorta uitstroomkanaal) en LVOT-diameter. In het bijzonder wordt SV, of de hoeveelheid bloed die per slag door het linkerventrikel wordt uitgestoten, berekend door LVOT VTI × dwarsdoorsnedegebied van de LVOT.32 Om de LVOT-diameter te meten, plaatst u de phased array-sonde in de parasternale lengteasweergave en meet u de afstand van de LVOT net boven de aortaklep in het midden van de systole. VTI wordt gemeten in de apicale-5-kamerweergave. Door gebruik te maken van de pulsgolf-dopplermodus wordt de dopplergolf net boven de aortaklep geplaatst en worden dopplergolfvormen geregistreerd. Zorg ervoor dat de as zo goed mogelijk is uitgelijnd met het uitstroomkanaal om over- / onderschattingen te voorkomen. Na het selecteren van het “LVOT VTI” -meetinstrument, meet u de golfvorm van één uitwerpperiode.33,34 Normale LVOT VTI varieert van 18-22 cm, hoewel mogelijk lager met HRs > 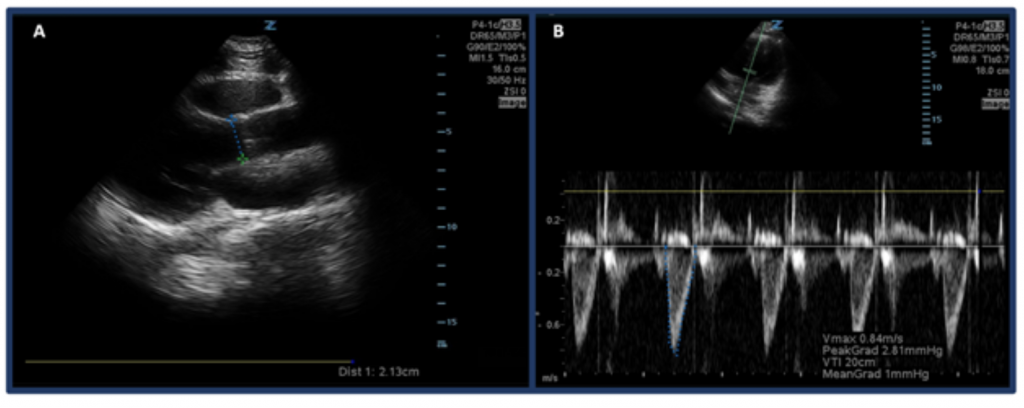
Aanbevolen evaluatietraject
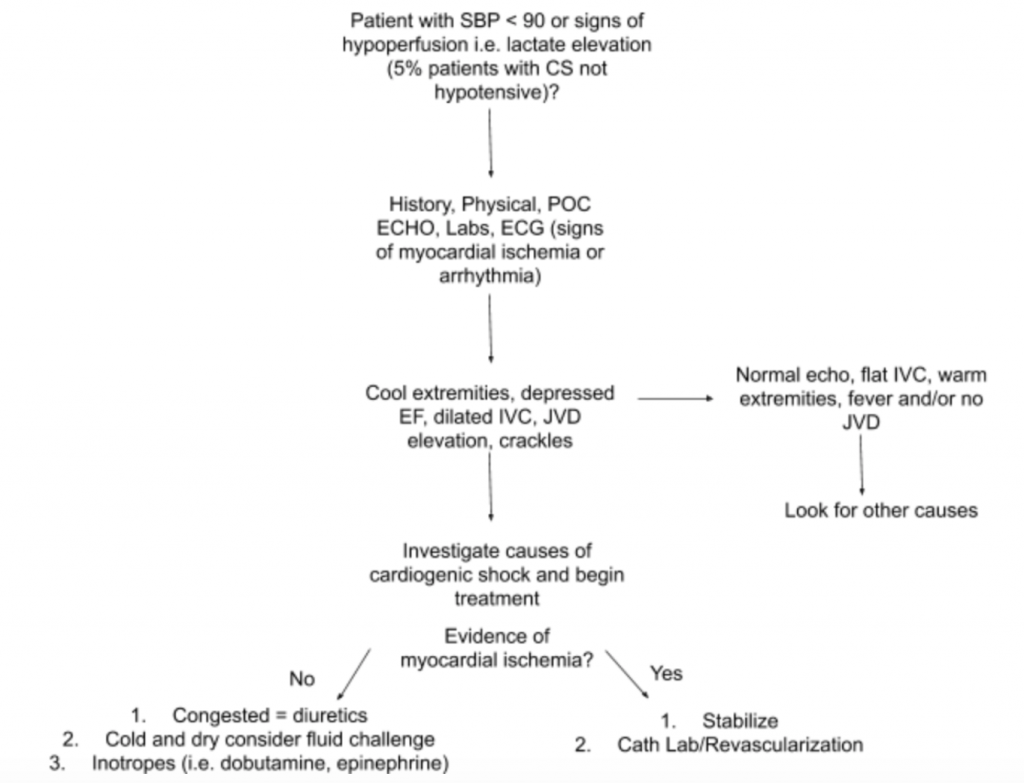
Zoals hierboven besproken, is er geen enkele examenbevinding of laboratoriumtest die een diagnose kan stellen CS. Daarom, wanneer er een hoog vermoeden van CS is in de setting van hypotensie of tekenen van hypoperfusie, raden we aan om anamnese, een gedetailleerd lichamelijk onderzoek, VS aan het bed, laboratoria (met name creatinine, lactaat, troponine, BNP en andere markers van / eindorgaan-schade), en ECG (aangezien acute MI de primaire oorzaak is van CS en tekenen van ischemie en mogelijk moet revascularisatie) om te helpen bij de diagnose (zie figuur 5). Overweeg een arteriële kathetermonitor voor BP en begeleid de behandeling. Naast een gericht hart- en longonderzoek, moet lichamelijk onderzoek zich richten op de perfusie van JVD en extremiteiten. Het hierboven besproken RUSH-onderzoek en de berekening van EF / CO / CI via LVOT VTI-metingen zijn waardevolle aanvullingen op de evaluatie. Het gebruik van een alomvattende benadering om te evalueren op CS zal een beter begrip van deze heterogene ziekte creëren en het management helpen begeleiden.
Conclusie van de casus : Bij verdere evaluatie wordt de jugulaire veneuze druk van de patiënt verhoogd tot 10 cmH20, en zijn voeten zijn koel met een vertraagde capillaire vulling. Bedside RUSH-onderzoek toont bilateraal diffuus longoedeem en een geschatte lage EF.LVOT VTI wordt gemeten op slechts 10 cm. EKG toont ST-verhogingen in de precordiale afleidingen. Lactaat en troponine zijn licht verhoogd. De patiënt wordt gestabiliseerd met een korte proef met dobutamine, IV furosemide en CPAP met een matige verbetering van de vitale functies en ademhalingsstatus, en vervolgens naar het katheterisatielab gestuurd voor opkomende PCI.
Punten om mee naar huis te nemen:
- CS wordt voornamelijk veroorzaakt door een acuut MI (~ 70%) en is de focus van de meeste onderzoeken, maar er moet ook rekening worden gehouden met andere oorzaken (zie volledige lijst in figuur 1).
- Sterfte secundair aan CS blijft hoog (~ 60%), hoewel vroege identificatie en interventie de overleving verbetert.
- Voer een zorgvuldig lichamelijk onderzoek uit op zoek naar hypoperfusie en congestie. JVP is een belangrijk onderdeel van lichamelijk onderzoek voor de diagnose van CS en wordt geassocieerd met verhoogde mortaliteit (RR = 1,52).
- Het RUSH-onderzoek is zowel gevoelig als specifiek (respectievelijk 0,89 en 0,97) bij de diagnose van CS. De echografie aan het bed moet vaak worden herhaald omdat de meeste patiënten zich aanvankelijk niet in CS presenteren.
- Het gebruik van LVOT VTI is een eenvoudige en niet-invasieve methode voor het evalueren van CO met lage metingen die gepaard gaan met nadelige resultaten.
- Een voorgestelde benadering voor het evalueren van patiënten met verdenking op CS met de nadruk op de heterogene pathologie en presentatie ervan is samengevat in figuur 5.
FOAMed-bronnen:
- EM in 5 : Shock
- emDocs: cardiogene shock
- emDocs: ED-beheer van hartfalen – parels en valkuilen
- emDocs: RUSH (“Rapid Ultrasound for Shock”) -protocol
- emDocs: de hypotensieve ED-patiënt: een sequentiële systematische benadering
- Eerste 10 EM: ongedifferentieerde hypotensie
