Tilfelle: En 73 år gammel mann med en historie med hypertensjon, koronararteriesykdom og tidligere hjerteinfarkt infarkt (MI) presenteres for beredskapsavdelingen (ED) med tretthet, kortpustethet, redusert urinutgang og hevelse i ankelen. Ved ankomst inkluderer hans vitale tegn BP 87/58 mm Hg, HR 102, RR 24, T-metning 86% på romluft og temperatur 98,2 F, og han har knitrende på auskultasjon. Hvordan vil du håndtere denne pasienten?
Hva er kardiogent sjokk?
Selv om definisjonene varierer, er kardiogent sjokk (CS) en klinisk diagnose bredt definert som en tilstand med lavt hjerteutgang med tilhørende utilstrekkelig end-organ perfusjon, eller vevshypoperfusjon sekundært til hjerteskade. 1 Vanlige kriterier avledet fra SHOCK-studien består av hypotensjon (SBP < 90mmHg eller > 90mmHg med støttende pleie), bevis på slutt- organ hypoperfusjon og hjerteindeks (CI) < 2,2 L / min / m2 eller lungekapillært kiletrykk ≥ 15 mmHg 2,3 Selv om denne definisjonen er nyttig for å standardisere inklusjonskriterier for kliniske studier , det er mindre verdifullt for å diagnostisere CS i beredskapsavdelingen (ED). Ved skift i en travel ED, kan CS være utfordrende å diagnostisere på grunn av forskjellige presentasjoner, overlapping med andre sjokktilstander (dvs. sepsis), dårlig forstått patofysiologi, komplekse og multifaktorielle årsaker og varierte hemodynamiske parametere.4 I fravær av invasiv hjerteutgang (CO) og PCWP-verdier, kan CS utledes ved hjelp av bevis på forhøyede fyllingstrykk (dvs. lungestopp eller forhøyet JVP), kliniske tegn på hypoperfusjon og en historie og ekko som tyder på hjertesvikt. Dødeligheten sekundær til CS er høy (~ 25-70%), men tidlig anerkjennelse og intervensjon forbedrer overlevelsen.4,5 Legevakter har muligheten til å diagnostisere CS ved innleggelse og må opprettholde en høy klinisk mistanke når de ser en kritisk syk pasient. Denne gjennomgangen vil fokusere på anerkjennelse og tips om hvordan du ikke kan gå glipp av diagnosen CS gjennom fysisk eksamen, laboratorier, ultralyd ved sengen og bildebehandling.
Hva er årsakene til kardiogent sjokk?
De fleste studier av CS fokuserer på pasienter med CS sekundær til hjerteinfarkt (MI) som involverer venstre ventrikkel. Selv om MI er den primære årsaken til CS (~ 70%), må enhver årsak til ventrikulær dysfunksjon og redusert CO eller hjerteindeks (CO / kroppsoverflate) som en potensiell årsak vurderes.6 Dette inkluderer, men er ikke begrenset til, ikke-iskemiske årsaker til høyre hjertesvikt, myokarditt, takotsubo-kardiomyopati, hypertrofisk kardiomyopati eller valvulær hjertesykdom (tabell 1). For å gjøre ting mer utfordrende, er CS et kontinuum snarere enn en statisk tilstand, alt fra forverret hjertesvikt til ildfast sjokk med irreversibel organskade (Figur 1). CS blir enda mer variabel med forekomst av sekundære fornærmelser som arytmier eller progressiv iskemi og acidose.3 Det skal bemerkes at i 2/3 av tilfellene er CS ikke tilstede ved innleggelse, men utvikler seg senere innen 48 timer etter innleggelse som pasienten utvikler seg nedover sjokkkontinuumet.7 Det er viktig å revurdere pasientenes vitale tegn, symptomer, fysisk undersøkelse og ekko ved sengen.

Tabell 1: Årsaker til CS, tilpasset fra Parrillo & Dellinger (2013). 8 70% av CS-tilfellene er forårsaket av akutte MI.6 Effekter av akutt MI med tilhørende prosenter hentet fra resultatene av SHOCK-prøveregisteret.9.10
Figur 1: Continuum of CS, tilpasset fra Bellumkonda et al. . (2018) .3 Dette spekteret kan avvike med sekundære fornærmelser (f.eks. Nye arytmier).
Dødelighet i kardiogent sjokk
Selv om dødeligheten sekundær til CS fortsatt er høy, er 4 tidlig gjenkjenning og intervensjon forbedrer overlevelse.5 Ved å bruke data som inkluderte SHOCK-prøveregisteret, var 30-dagers dødelighet på sykehus hos 1117 pasienter som ble diagnostisert med CS sekundær til venstre hjertekammer (LV) eller høyre hjertekammer (RV) svikt på grunn av en akutt MI 57% . Hvis du tar flere risikofaktorer i betraktning, spesielt sjokk ved innleggelse, alder, tidligere koronar bypass-grafting (CABG), noninferior MI, kreatinin > 1,9 mg / dL, redusert SBP, anoksisk hjerneskade og klinisk bevis for hyporganfusjon i enden av organer, kunne pasienter deles med dødelighet fra 12% til 88% .11 I GRACE-studien ble CS svakt, men betydelig redusert mellom 1999 og 2006, sannsynligvis på grunn av økt bruk av perkutan koronar intervensjon (PCI), en viktig form for tidlig intervensjon for pasienter med MI komplisert av CS.12 Selv når pasienter stratifiserte basert på risikofaktorer, hadde PCI og CABG nytte av både pasienter med lav og høy risiko.11 Tidlig diagnose og passende behandling gjenstår, spesielt i tilfelle hjerteinfarkt, en viktig modifiserbar bidragsyter til utfall for pasienter med CS.
I tillegg, jo lenger CS utvikler seg, desto mer sannsynlig vil det være en maladaptiv inflammatorisk respons sekundært til en økning i cytokiner som TNF-alfa og IL-6, som hemmer hjerteaktivitet. 4,13 Det er også en økning av vasopressin og angiotensin II, som øker etterbelastning, forverrer CO og øker vann- og saltretensjon, og forårsaker lungeødem. Nitrogenoksid (NO) økes også gjennom aktivering av NO-syntase, noe som fører til vasodilatasjon og hjerteinfarkt depresjon. Alle disse maladaptive responsene på lav CO og hjerteinfarkt fører til forverret hjertevevskade, deprimert CO og distribusjonssjokk. Det skal bemerkes at noen tilfeller av CS er iatrogene når pasienter på randen av hjertesvikt blir behandlet med aggressive diuretika, nitrater, betablokkere, ACEI og morfin. 14 Som den første legen som evaluerer pasienter, må akuttmedisinere derfor identifisere og behandle CS på en tidssensitiv og klinisk passende måte.
Klinisk evaluering
Klassisk, pasienter med CS tilstede med klager over dyspné, brystsmerter, tretthet og / eller ankelhevelse.15 Fysisk undersøkelse kan avsløre tegn på overbelastning, inkludert perifert ødem, jugular venøs distensjon (JVD), knitrende / rales på auskultasjon, og tegn på hypoperfusjon som kul, dårlig perfuserte ekstremiteter (tabell 2). I en liten retrospektiv gjennomgang av 30 pasienter i udifferensiert sjokk, var det mer sannsynlig at de med CS hadde JVD (80% sammenlignet med 0% og 20%), kald hud (57,1% sammenlignet med 14,3% og. 28,5%) og lunge rales (75% mot 16,7% og 8,3%) sammenlignet med pasienter med henholdsvis distributivt og hypovolemisk sjokk.16 I en annen prospektiv studie med 68 pasienter brukte beboerne spesifikke kliniske undersøkelsesfunn for å skille kategorier av sjokk. CS ble kategorisert av SBP mindre enn 90, tegn på lav produksjon (kalde hender, dårlig kapillærpåfylling og svak puls), forhøyet jugular venous pressure (JVP) > 7 cmH2O, S3 galopp , og knitrer til 1/3 av lungene. Av 68 pasienter oppfylte 11 kriterier for CS. Hos pasienter med ekkokardiografisk bevis på lavt hjertevolum, forutsa forhøyet JVP CS med en nøyaktighet på 80%, noe som var uendret når man la tilstedeværelsen av knitrer.17
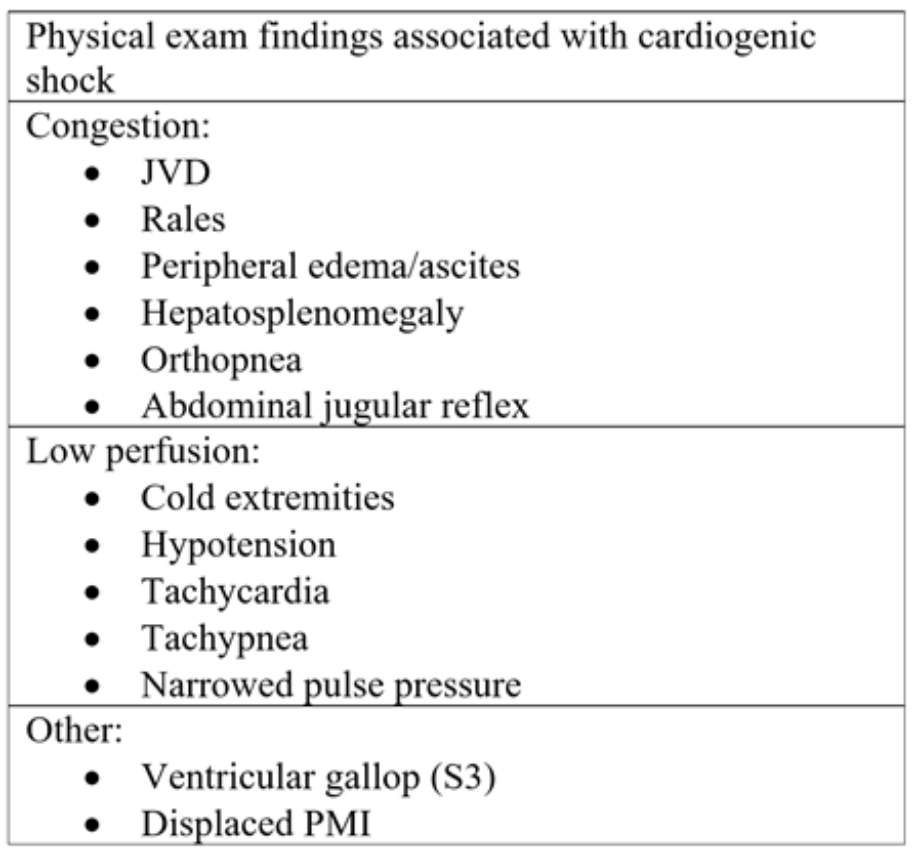
Tabell 2: Fysiske undersøkelseskomponenter sett ved akutt hjertesvikt og påfølgende kardiogent sjokk.18
Selv om JVP er en nyttig proxy for forhøyet kiletrykk, 19 kan det være vanskelig å vurdere på grunn av kroppens habitus og posisjonering av pasienten (sengehodet skal være forhøyet 45 grader, noe som kan være vanskelig hos pasienter med alvorlig ortopné). 20 JVP måles ved å beregne det høyeste pulseringspunktet i cm over brystvinkelen og tilsett deretter 5 (som høyre atrium er 5 cm under brystvinkelen), som korrelerer med distensjon i cmH20 (figur 2). Forhøyede verdier blir ofte ansett som større enn 6-8 cmH20.18 Det er bemerket at forhøyet JVP er assosiert med økt risiko for dødelighet, med en relativ risiko (RR) på 1.52.18
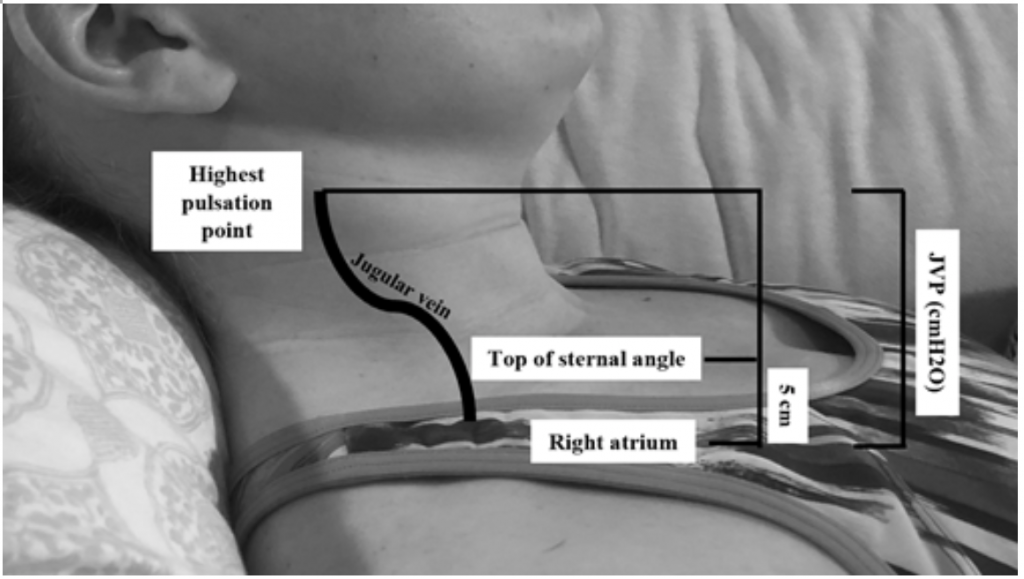
Figur 2: Måling av JVP, tilpasset fra Shah & Cowger (2014) .18
Labs kan vise en metabolsk acidose (ettersom laktat øker på grunn av perifer iskemi), nyrehypoperfusjon med resulterende akutt nyreskade og mulig bevis på hjerte-iskemi med forhøyede troponin- og EKG-endringer.15 I CardShock-studien ble en multisenter, prospektiv observasjonsstudie av 219 CS pasienter, var laktatnivåer signifikant assosiert med økt dødelighet (justert oddsforhold på 1,4) .6 Det er viktig å merke seg at heving av laktat ikke er spesifikk for sepsis og kan sees i en hvilken som helst hypoperusert tilstand som CS.
På den annen side holder ikke disse fysiske undersøkelsesfunnene og de hemodynamiske parametrene seg. I en studie ved bruk av SHOCK Trial-registeret hadde 5,2% av CS-pasientene ikke åpen hypotensjon, selv om de hadde tegn på perifer hypoperfusjon og lav KI.21 Dette er sannsynligvis på grunn av en adaptiv katekolaminfrigjøring i tidlig CS, noe som øker systemisk vaskulær motstand ( SVR) og opprettholder forbigående blodtrykk, men generelt med et smalt pulstrykk.22 Selv pasienter med klinisk signifikant lungeødem på bildebehandling kan ha tungpustethet eller til og med klare lungelyder i stedet for rales.23 I en studie ble lungetetthet bare sett i omtrent 2/3 tilfeller av CS sekundært til MI.21 Videre, selv med nedsatt LV-kontraktilitet, kan CS-pasienter ikke ha en alvorlig reduksjon i LVEF. 14,24 Faktisk er gjennomsnittlig EF i en kohort av CS-pasienter omtrent 30%, noe som er redusert, men høyere enn forventet.2
Selv om undersøkelsen ikke er perfekt, kan en detaljert fysisk undersøkelse som ser etter tegn på overbelastning og perifer hypoperfusjon sammen med en nøye gjennomgang av vitale tegn og laboratorier, være det første hintet pasienten din har kardiogent sjokk.
Behandlingssted ECHO for evaluering av kardiogent sjokk
Når pasienter presenterer seg for ED hypotensiv eller hypoperus, er RUSH-undersøkelsen en rask måte å differensiere sjokk ved å se på «pumpen, tanken og rørene. » Estimering av utkastningsfraksjon (EF) og CO (som CO = slagvolum (SV) x hjertefrekvens (HR)) gjennom ganske enkelt «eyeballing» LV-klemme er en tilstrekkelig vurdering av leger i akutt setting.27 I CS er den nedre vena cava (IVC), som er en indirekte måling av effektiv intra vaskulært volum, bør ha en diameter på > 2 cm i diameter og kollapser mindre enn 50% med inspirasjon. Disse funnene korrelerer med et forhøyet sentralt venetrykk.28 IVC-vurderingen kan imidlertid være unøyaktig hvis pasienten allerede har mottatt vasodilatatorer, diuretika og / eller er ventilert.29 Brystvinduer vil sannsynligvis vise lungeødem i form av overdreven B linjer («lungeraketter») som er resultatet av septalfortykning fra akkumulering av vann i interstitium.30 Sammen med lungetetthet kan det være pleural og peritoneal væske ved RUSH-undersøkelse.25 I en metaanalyse som brukte data fra tre originale papirer og to saksrapporter, ble RUSH-protokollen vist å være både sensitiv og spesifikk (henholdsvis 0,89 og 0,97) i diagnosen CS.31 Til tross for et høyt resulterende positivt sannsynlighetsforhold (LR) på 22,29, var det bare et moderat negativt LR på 0,17, noe som tyder på at RUSH-eksamen ikke er den perfekte testen for å utelukke CS. Derfor bør RUSH-eksamen brukes i sammenheng med en nøye historie og fysisk eksamen i stedet for å brukes alene for å diagnostisere kardiogener c sjokk.
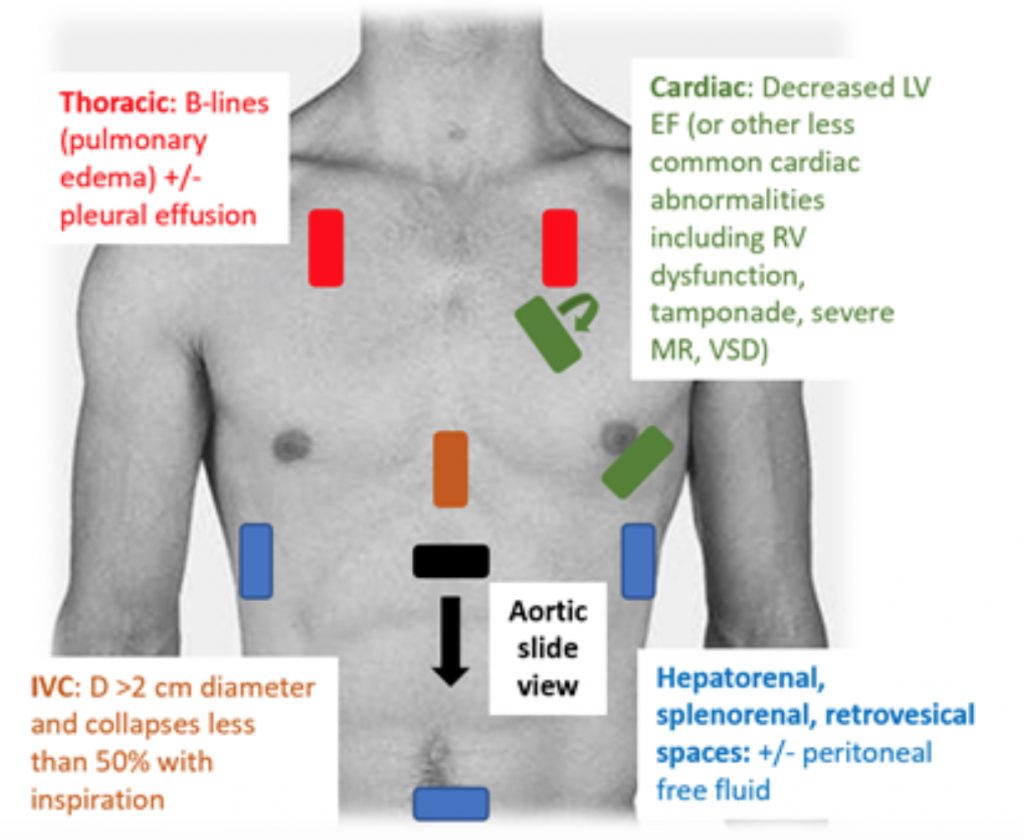
Figur 3: RUSH nattbord US eksamen for evaluering av udifferensiert hypotensjon med tilhørende funn som tyder på CS.25 , 26,29,30
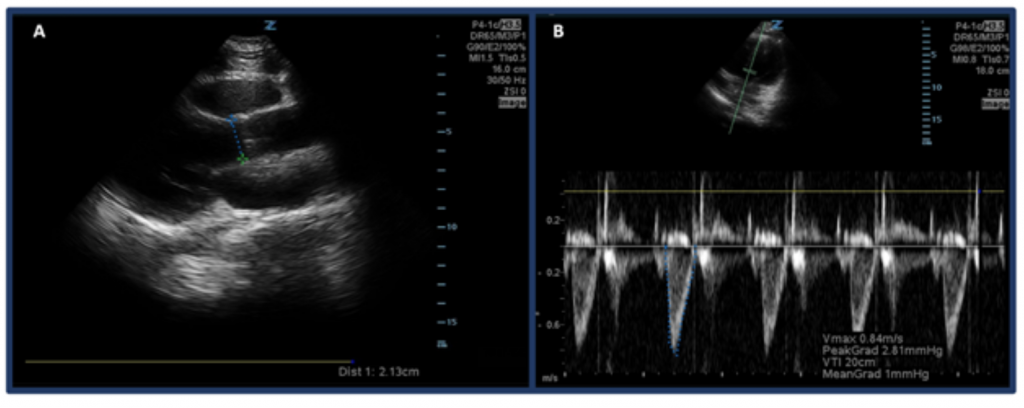
I stedet for bare å estimere CO gjennom «eyeballing», er en måte å måle CO med ultralyd på først å bestemme SV ved å bruke venstre ventrikkel utstrømningshastighet tidsintervall (LVOT VTI, eller hastighetene blodstrøm ved aortautstrømningskanalen) og LVOT-diameter. Nærmere bestemt blir SV, eller mengden blod som kastes ut gjennom venstre ventrikkel per slag, beregnet av LVOT VTI × tverrsnittsareal av LVOT .32 For å måle LVOT-diameter, plasser den trinnvise array-sonden i parasternens langsakse og måler avstanden til LVOT rett over aortaklaffen mens du er i midten av systolen. VTI måles i apikal-5-kammervisning. Ved bruk av pulserende doppler-modus plasseres dopplerbølgen like over aortaklaffen, og dopplerbølgeformer registreres. Sørg for å rette aksen opp mot utløpskanalen så godt som mulig for å unngå over / under estimeringer. Etter å ha valgt «LVOT VTI» måleverktøy måler du bølgeformen til en utkastingsperiode. 33,34 Normal LVOT VTI varierer fra 18-22 cm, men muligens lavere med HR > 95 bpm. 35 Hos pasienter med atrieflimmer, vil VTI-målinger sannsynligvis være en undervurdering av den sanne verdien, og derfor foreslås det gjennomsnitt av 3-5 påfølgende bølgeformer. Som man forventer, er det en sammenheng mellom lav LVOT VTI og uønskede utfall.32
Anbefalt evalueringsvei
Som diskutert ovenfor er det ikke en eneste undersøkelsesundersøkelse eller laboratorietest som kan diagnostisere CS. Derfor, når det er høy mistanke om CS i forbindelse med hypotensjon eller tegn på hypoperfusjon, foreslår vi at du bruker historie, en detaljert fysisk undersøkelse, USA ved sengen, laboratorier (spesielt kreatinin, laktat, troponin, BNP og andre markører for hypoperfusjon / organskade), og EKG (som akutt MI er den primære årsaken til CS og tegn på iskemi og kan kreve fremvoksende revaskularisering) for å hjelpe til med diagnose (se figur 5). Vurder en arteriell katetermonitor til BP og veiled behandling. Utover en fokusert hjerte- og lungeundersøkelse, bør fysisk eksamen fokusere på JVD og ekstremitetsperfusjon. RUSH-eksamen og beregning av EF / CO / CI gjennom LVOT VTI-målinger diskutert ovenfor er verdifulle tillegg til evalueringen. Ved å bruke en omfattende tilnærming for å evaluere for CS vil det skape bedre forståelse av denne heterogene sykdommen og hjelpe deg med ledelse.
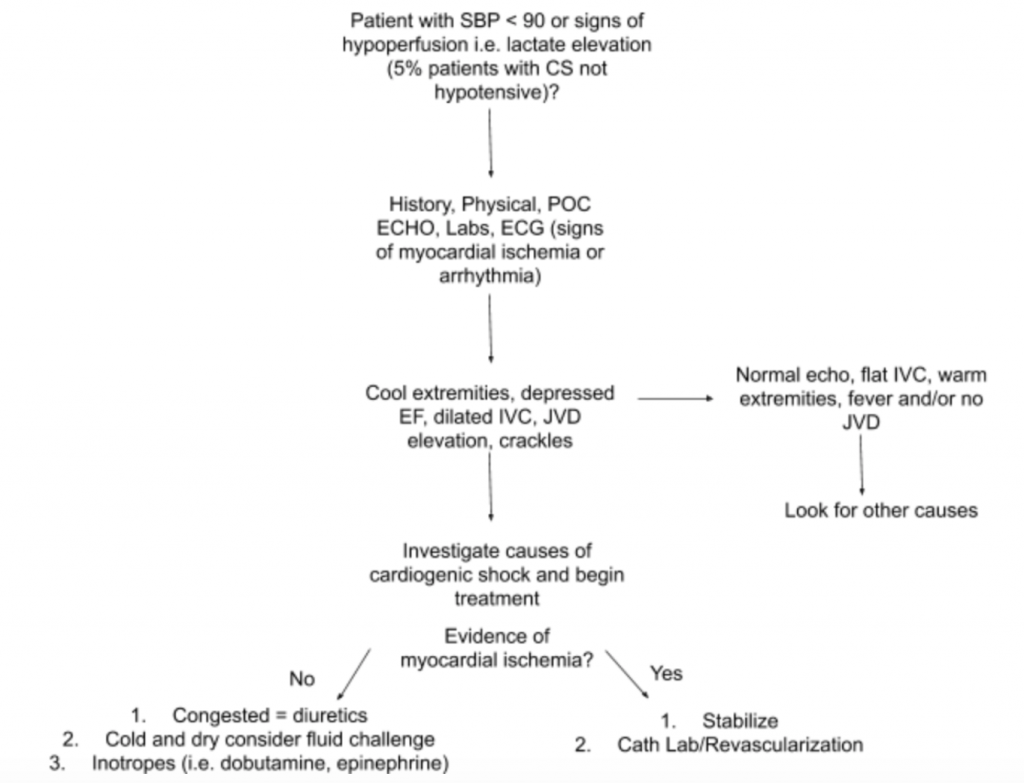
Sakskonklusjon : Ved videre evaluering blir pasientens venetrykk i halsen forhøyet til 10 cmH20, og føttene er kule med forsinket kapillærpåfylling. RUSH-undersøkelse ved sengen viser bilateralt diffust lungeødem og en estimert lav EF.LVOT VTI måles til bare 10 cm. EKG viser ST-høyder i de førordiske ledningene. Laktat og troponin er mildt forhøyet. Pasienten blir stabilisert med en kort studie av dobutamin, IV furosemid og CPAP med moderat forbedring i vitalitet og respiratorisk status, og deretter sendt til cath lab for fremvoksende PCI.
Ta med deg poeng:
- CS er primært forårsaket av en akutt MI (~ 70%) og er fokus for de fleste studier, men andre årsaker bør også vurderes (se full liste i figur 1).
- Dødeligheten sekundær til CS er fortsatt høy (~ 60%), selv om tidlig identifisering og intervensjon forbedrer overlevelsen.
- Utfør en nøye fysisk undersøkelse på jakt etter hypoperfusjon og opphopning. JVP er en viktig fysisk undersøkelseskomponent for diagnosen CS og er assosiert med økt dødelighet (RR = 1,52).
- RUSH-eksamen er både sensitiv og spesifikk (henholdsvis 0,89 og 0,97) i diagnosen CS. Ultralyd ved sengen bør gjentas ofte, ettersom de fleste pasienter i utgangspunktet ikke er tilstede i CS.
- Bruk av LVOT VTI er en enkel og ikke-invasiv metode for å evaluere CO med lave målinger assosiert med ugunstige resultater.
- En foreslått tilnærming for evaluering av pasienter med mistenkt CS med fokus på dens heterogene patologi og presentasjon er oppsummert i figur 5.
FOAMed Resources:
- EM in 5 : Sjokk
- emDocs: Kardiogent sjokk
- emDocs: ED Management of Heart Failure- Pearls and Fallfalls
- emDocs: RUSH («Rapid Ultrasound for Shock») Protocol
- emDocs: Den hypotensive ED-pasienten: En sekvensiell systematisk tilnærming
- Første 10 EM: Udifferensiert hypotensjon
