Caso: Varón de 73 años con antecedentes de hipertensión, enfermedad de las arterias coronarias y antecedentes de miocardio. El infarto (IM) se presenta en el departamento de emergencias (DE) con fatiga, dificultad para respirar, disminución de la producción de orina e hinchazón del tobillo. A su llegada, sus signos vitales incluyen PA 87/58 mm Hg, FC 102, RR 24, saturación de T 86% con aire ambiente y temperatura 98,2 F, y tiene crepitaciones en la auscultación. ¿Cómo manejaría a este paciente?
¿Qué es el shock cardiogénico?
Aunque las definiciones varían, el shock cardiogénico (SC) es un diagnóstico clínico que se define ampliamente como un estado de bajo gasto cardíaco con Perfusión inadecuada de órganos terminales o hipoperfusión tisular secundaria a daño cardíaco. 1 Los criterios comúnmente utilizados derivados del ensayo SHOCK consisten en hipotensión (PAS < 90 mmHg o > 90 mmHg con cuidados de apoyo), evidencia de hipoperfusión de órganos e índice cardíaco (IC) < 2,2 L / min / m2 o presión de enclavamiento capilar pulmonar ≥ 15 mmHg 2,3 Aunque esta definición es útil para estandarizar los criterios de inclusión para ensayos clínicos , es menos valioso para el diagnóstico de SC en el servicio de urgencias (SU). En un turno en un servicio de urgencias ocupado, el SC puede ser difícil de diagnosticar debido a las diversas presentaciones, la superposición con otros estados de shock (es decir, la sepsis), la fisiopatología poco conocida, las causas complejas y multifactoriales y los parámetros hemodinámicos variados.4 En ausencia de gasto cardíaco invasivo (CO) y PCWP, CS se puede inferir usando evidencia de presiones de llenado elevadas (es decir, congestión pulmonar o JVP elevada), signos clínicos de hipoperfusión y antecedentes y eco sugestivos de insuficiencia cardíaca. La mortalidad secundaria al SC es alta (~ 25-70%), pero el reconocimiento y la intervención tempranos mejoran la supervivencia4,5.Los médicos de urgencias tienen la oportunidad de diagnosticar el SC al ingreso y deben mantener una alta sospecha clínica al ver a cualquier paciente crítico. Esta revisión se centrará en el reconocimiento y los consejos sobre cómo no perder el diagnóstico de SC a través de exámenes físicos, laboratorios, ecografías e imágenes de cabecera.
¿Cuáles son las causas del shock cardiogénico?
La mayoría de los estudios de SC se centran en pacientes con SC secundario a infartos de miocardio (IM) que afectan al ventrículo izquierdo. Aunque los infartos de miocardio son la causa principal de SC (~ 70%), se debe considerar cualquier causa de disfunción ventricular y reducción de CO o índice cardíaco (CO / área de superficie corporal) como una causa potencial.6 Esto incluye, pero no se limita a, causas no isquémicas de insuficiencia cardíaca derecha, miocarditis, miocardiopatía de takotsubo, miocardiopatía hipertrófica o cardiopatía valvular (tabla 1). Para hacer las cosas más desafiantes, el CS es un estado continuo en lugar de estático, que va desde el empeoramiento de la insuficiencia cardíaca hasta el choque refractario con daño irreversible de los órganos terminales (Figura 1). El SC se vuelve aún más variable con la aparición de agresiones secundarias como arritmias o isquemia progresiva y acidosis3. Cabe señalar que en 2/3 de los casos, el SC no está presente al ingreso pero se desarrolla más tarde dentro de las 48 horas posteriores a la hospitalización como el paciente progresa en el continuo del shock.7 Es importante reevaluar con frecuencia los signos vitales, los síntomas, el examen físico y el eco de cabecera del paciente.

Tabla 1: Causas de SC, adaptado de Parrillo & Dellinger (2013) .8 El 70% de los casos de SC son causados por IM agudos.6 Efectos del IM agudo con asociados porcentajes tomados de los resultados del registro del ensayo SHOCK.9.10
Figura 1: Continuum of CS, adaptado de Bellumkonda et al. . (2018) .3 Este espectro puede desviarse con agresiones secundarias (por ejemplo, nuevas arritmias).
Mortalidad en shock cardiogénico
Aunque la mortalidad secundaria a CS sigue siendo alta, 4 reconocimiento e intervención tempranos mejora la supervivencia.5 Utilizando datos que incluyeron el registro del ensayo SHOCK, la mortalidad hospitalaria a los 30 días de 1217 pacientes que fueron diagnosticados con SC secundario a insuficiencia del ventrículo izquierdo (VI) o ventrículo derecho (VD) debido a un IM agudo fue del 57% . Si tiene en cuenta varios factores de riesgo, específicamente shock al ingreso, edad, injerto de bypass de arteria coronaria (CABG) previo, infarto de miocardio no inferior, creatinina > 1,9 mg / dl, disminución de la PAS, anóxico lesión cerebral y evidencia clínica de hipoperfusión de órganos diana, los pacientes podrían subdividirse con una mortalidad que oscila entre el 12% y el 88% .11 En el ensayo GRACE, el CS disminuyó débil pero significativamente entre 1999 y 2006, probablemente debido al aumento del uso de percutáneos intervención coronaria (ICP), una forma importante de intervención temprana para los pacientes con IM complicado por SC.12 Incluso cuando se estratificaron a los pacientes en función de los factores de riesgo, la ICP y la CABG beneficiaron tanto a los pacientes de bajo como de alto riesgo.11 El diagnóstico precoz y el tratamiento adecuado siguen siendo, en particular en el caso de la isquemia miocárdica, un importante factor modificable que contribuye a los resultados de los pacientes con SC.
Además, cuanto más tiempo avanza el SC, es más probable que se produzca un trastorno inflamatorio desadaptativo. respuesta secundaria a un aumento de citocinas como TNF-alfa e IL-6, que inhiben la actividad cardíaca. 4,13 También hay un aumento de vasopresina y angiotensina II, que aumenta la poscarga, empeora el CO y aumenta la retención de agua y sal, provocando edema pulmonar. El óxido nítrico (NO) también aumenta mediante la activación de la NO sintasa, lo que provoca vasodilatación y depresión miocárdica. Todas estas respuestas desadaptativas al CO bajo y la isquemia miocárdica dan lugar a un empeoramiento del daño tisular cardiaco, CO deprimido y choque distributivo. Cabe señalar que algunos casos de SC son iatrogénicos, cuando los pacientes al borde de la insuficiencia cardíaca son tratados con diuréticos agresivos, nitratos, betabloqueantes, IECA y morfina. 14 Por lo tanto, como el primer médico en evaluar a los pacientes, los médicos de urgencias deben identificar y tratar el SC de una manera sensible al tiempo y clínicamente apropiada.
Evaluación clínica
Clásicamente, los pacientes con SC presenta quejas de disnea, dolor en el pecho, fatiga y / o hinchazón del tobillo.15 El examen físico puede revelar signos de congestión que incluyen edema periférico, distensión venosa yugular (JVD), crepitantes / estertores en la auscultación y signos de hipoperfusión como frío, extremidades mal perfundidas (tabla 2). En una pequeña revisión retrospectiva de 30 pacientes en shock indiferenciado, aquellos con SC tenían más probabilidades de tener EVI (80% en comparación con 0% y 20%), piel fría (57,1% en comparación con 14,3% y 28,5%) y pulmón. estertores (75% frente a 16,7% y 8,3%) en comparación con pacientes con shock distributivo e hipovolémico, respectivamente.16 En otro estudio prospectivo con 68 pacientes, los residentes utilizaron los resultados del examen clínico específico para diferenciar categorías de shock. El SC se clasificó por PAS menor de 90, signos de bajo gasto (manos frías, llenado capilar deficiente y pulso débil), presión venosa yugular elevada (JVP) > 7 cmH2O, S3 galope y crepita a 1/3 de los pulmones. De 68 pacientes, 11 cumplieron los criterios de CS. En pacientes con evidencia ecocardiográfica de bajo gasto cardíaco, la JVP elevada predijo el CS con una precisión del 80%, que no cambió al agregar la presencia de crepitantes.17
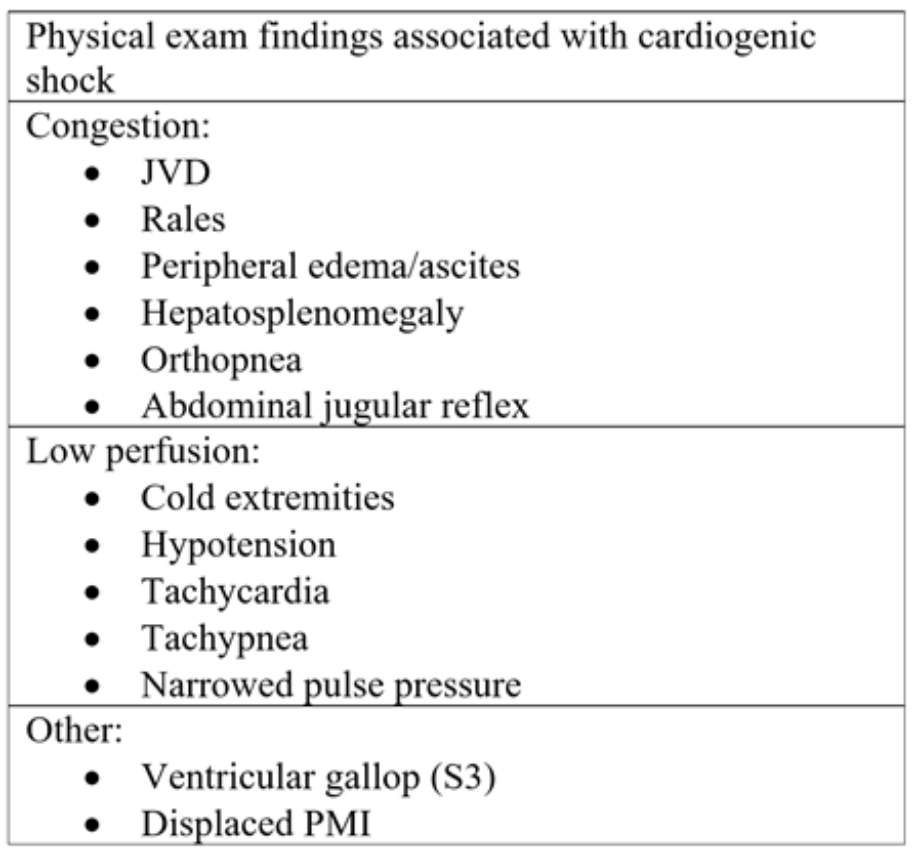
Tabla 2: Componentes del examen físico observados en la insuficiencia cardíaca aguda y el posterior shock cardiogénico.18
Aunque la JVP es un indicador útil de las presiones de enclavamiento elevadas, 19 puede ser difícil de evaluar debido al hábito corporal y la posición del paciente (la cabecera de la cama debe elevarse 45 grados, lo que puede ser difícil en pacientes con ortopnea severa) .20 La JVP se mide calculando el punto de pulsación más alto en cm por encima del ángulo esternal y luego agregando 5 (ya que la aurícula derecha está 5 cm por debajo del ángulo esternal), lo que se correlaciona con la distensión en cmH20 (Figura 2). Los valores elevados a menudo se consideran superiores a 6-8 cmH20.18 Es de destacar que la JVP elevada se asocia con un mayor riesgo de mortalidad, con un riesgo relativo (RR) de 1.52.18
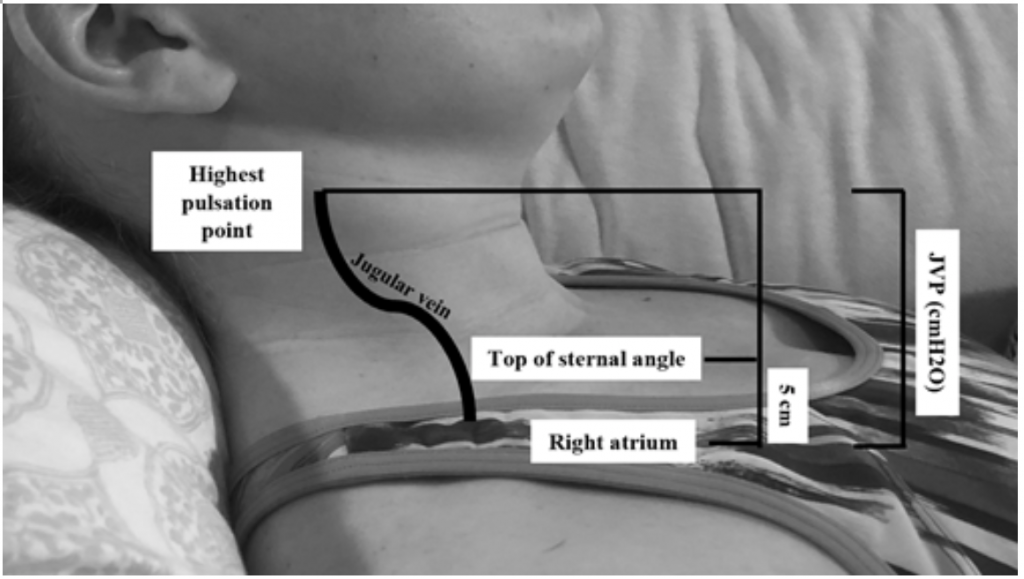
Figura 2: Midiendo JVP, adaptado de Shah & Cowger (2014) .18
Los laboratorios pueden mostrar una acidosis metabólica (a medida que aumenta el lactato debido a la isquemia periférica), hipoperfusión renal con lesión renal aguda resultante y posible evidencia de isquemia cardíaca con troponina elevada y cambios en el electrocardiograma.15 En el estudio CardShock, un estudio multicéntrico, prospectivo y observacional de 219 CS pacientes, los niveles de lactato se asociaron significativamente con una mayor mortalidad (razón de posibilidades ajustada de 1,4) .6 Es importante tener en cuenta que la elevación de lactato no es específica de la sepsis y puede verse en cualquier estado de hipoperfusión como CS.
Por otro lado, estos hallazgos del examen físico y parámetros hemodinámicos no siempre son ciertos. En un estudio que utilizó el registro SHOCK Trial, el 5,2% de los pacientes con SC no tenían hipotensión manifiesta, aunque sí tenían signos de hipoperfusión periférica e IC bajo.21 Esto probablemente se deba a una liberación adaptativa de catecolaminas en el SC temprano, que aumenta la resistencia vascular sistémica ( RVS) y mantiene transitoriamente la presión arterial, aunque generalmente con una presión de pulso estrecha.22 Incluso los pacientes con edema pulmonar clínicamente significativo en las imágenes pueden presentar sibilancias o incluso sonidos pulmonares claros en lugar de estertores.23 En un estudio, la congestión pulmonar solo se observó en aproximadamente 2/3 casos de CS secundario a MI.21 Además, incluso con una contractilidad del VI disminuida, los pacientes con CS pueden no tener una reducción severa de la FEVI. 14,24 De hecho, la FE media en una cohorte de pacientes con SC es de alrededor del 30%, que es reducida pero más alta de lo esperado.2
Aunque el examen no es perfecto, un examen físico detallado en busca de signos de congestión e hipoperfusión periférica junto con una revisión cuidadosa de los signos vitales y los análisis de laboratorio puede ser el primer indicio de que su paciente tiene un shock cardiogénico.
ECHO en el punto de atención para evaluar el shock cardiogénico
Cuando los pacientes se presentan en el servicio de urgencias hipotensos o hipoperfundidos, el examen RUSH es una forma rápida de diferenciar el shock al observar «la bomba, el tanque y las tuberías. ”25,26 Para el CS, el ecocardiograma transtorácico muestra clásicamente un VI hipodinámico, dilatado, con una compresión deficiente del VI y un movimiento inadecuado asociado de la valva anterior de la válvula mitral durante la sístole y la diástole (es decir, mala contractilidad). La estimación de la fracción de eyección (FE) y el CO (como CO = volumen sistólico (VS) x frecuencia cardíaca (FC)) a través de la compresión del VI simplemente «en globo ocular» es una evaluación adecuada por parte de los médicos en el contexto agudo.27 En CS, la vena inferior cava (IVC), que es una medida indirecta de la eficacia intra volumen vascular, debe tener un diámetro de > 2 cm de diámetro y colapsa menos del 50% con la inspiración. Estos hallazgos se correlacionan con una presión venosa central elevada.28 Sin embargo, la evaluación de la VCI puede ser inexacta si el paciente ya ha recibido vasodilatadores, diuréticos y / o está ventilado.29 Es probable que las ventanas torácicas muestren edema pulmonar en forma de B excesivo. líneas («cohetes pulmonares») que son el resultado del engrosamiento septal por la acumulación de agua en el intersticio.30 Junto con la congestión pulmonar, puede haber líquido pleural y peritoneal en el examen RUSH.25 En un metanálisis que utilizó datos de tres estudios y dos informes de casos, el protocolo RUSH demostró ser tanto sensible como específico (0,89 y 0,97, respectivamente) en el diagnóstico de SC.31 A pesar de una alta razón de probabilidad positiva (LR) resultante de 22,29, sólo hubo una moderada LR de 0.17, lo que sugiere que el examen RUSH no es la prueba perfecta para descartar CS. Por lo tanto, el examen RUSH debe usarse en el contexto de una historia clínica y un examen físico cuidadosos en lugar de usarse solo para diagnosticar enfermedades cardiovasculares. c shock.
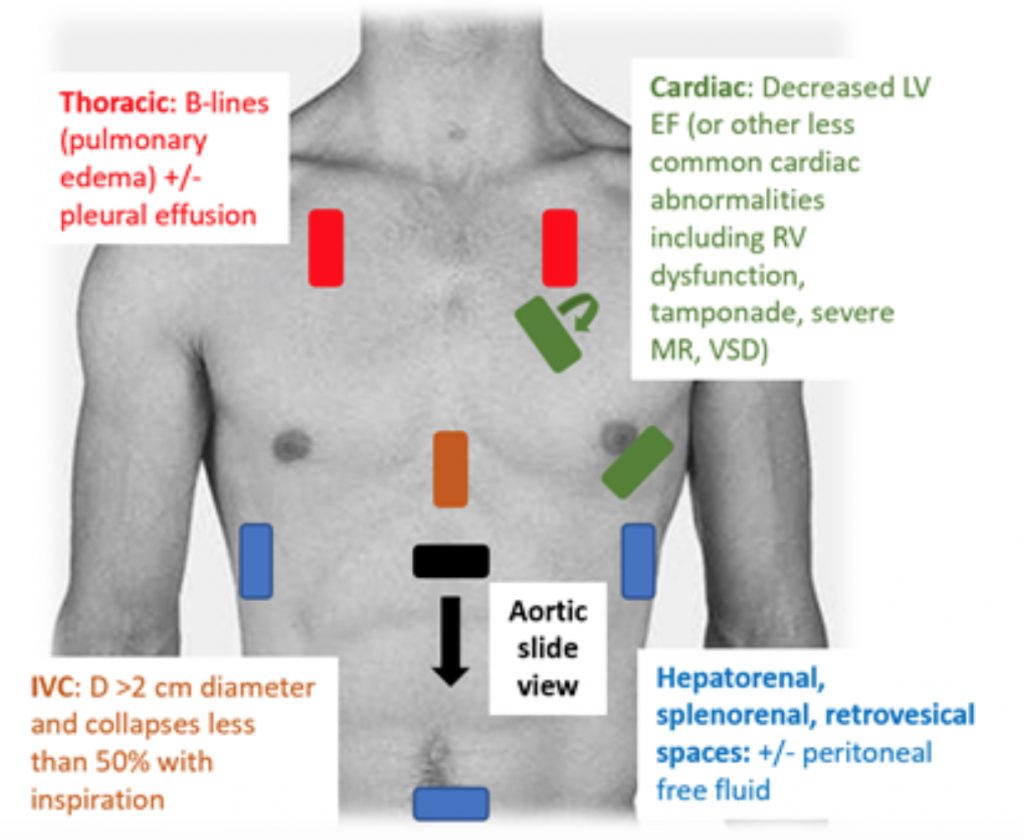
Figura 3: Examen de ecografía de cabecera RUSH para la evaluación de hipotensión indiferenciada con hallazgos asociados que sugieren SC.25 , 26,29,30
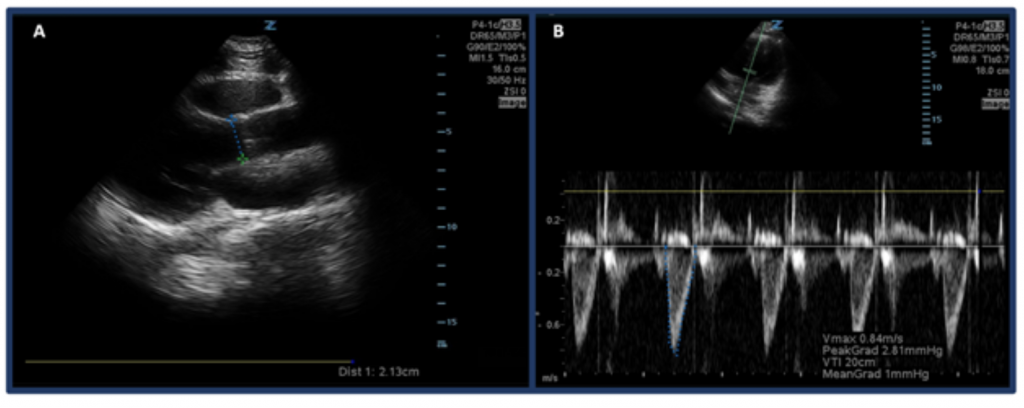
En lugar de simplemente estimar el CO a través del «globo ocular», una forma de medir el CO con ultrasonido es determinar primero el SV utilizando el intervalo de tiempo de velocidad del tracto de salida del ventrículo izquierdo (LVOT VTI, o las velocidades del flujo sanguíneo en el tracto de salida aórtico) y el diámetro del TSVI. Específicamente, el VS, o la cantidad de sangre expulsada a través del ventrículo izquierdo por latido, se calcula mediante el LVOT VTI × área de sección transversal del TSVI.32 Para medir el diámetro del TSVI, coloque la sonda de matriz en fase en la vista del eje largo paraesternal y mida el distancia del TSVI justo por encima de la válvula aórtica mientras se encuentra en la mitad de la sístole. La VTI se mide en la vista apical de 5 cámaras. Usando el modo Doppler de onda pulsada, la onda Doppler se coloca justo encima de la válvula aórtica y se registran las formas de onda Doppler. Asegúrese de alinear el eje con el tracto de salida de la mejor manera posible para evitar estimaciones excesivas o insuficientes. Después de seleccionar la herramienta de medición «LVOT VTI», mida la forma de onda de un período de eyección.33,34 El LVOT VTI normal varía de 18-22 cm, aunque posiblemente más bajo con FC > 95 lpm. 35 En pacientes con fibrilación auricular, las mediciones de VTI probablemente serán una subestimación del valor real y, por lo tanto, se sugiere un promedio de 3-5 formas de onda consecutivas.Como era de esperar, existe una correlación entre el TSVI bajo y los resultados adversos32 p. >
Vía de evaluación recomendada
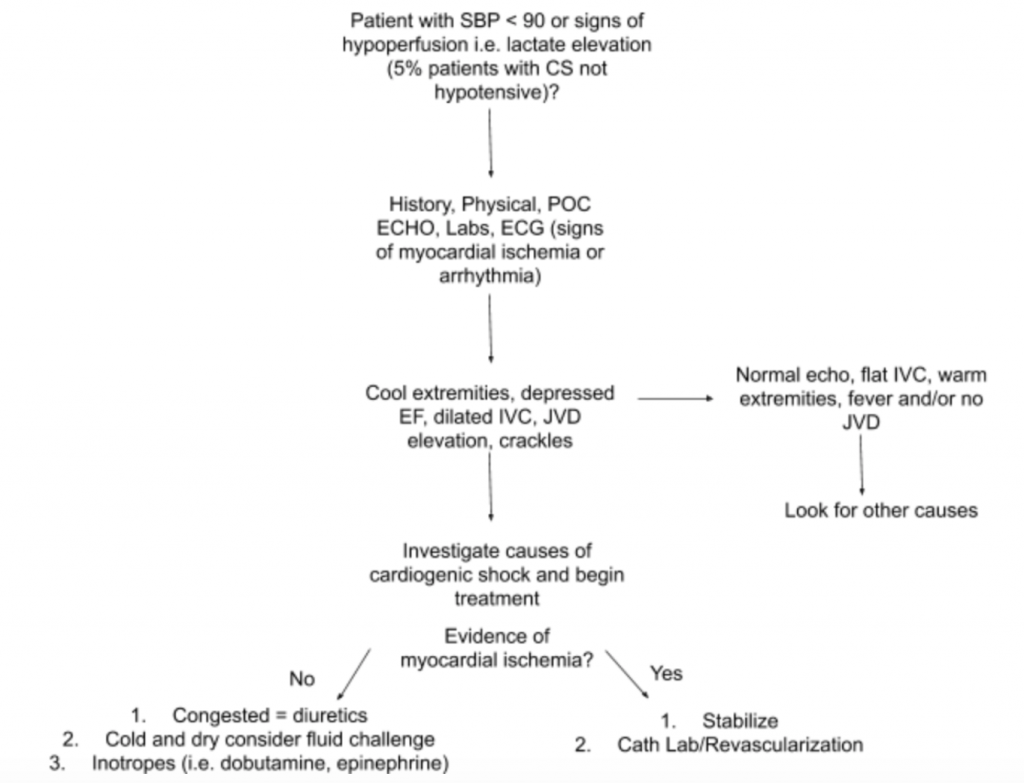
Como se mencionó anteriormente, no existe un solo resultado de examen o prueba de laboratorio que pueda diagnosticar CS. Por lo tanto, cuando existe una alta sospecha de CS en el contexto de hipotensión o signos de hipoperfusión, sugerimos usar la historia, un examen físico detallado, ecografía de cabecera, análisis de laboratorio (específicamente creatinina, lactato, troponina, BNP y otros marcadores de hipoperfusión / daño de órgano terminal) y electrocardiograma (ya que el infarto de miocardio agudo es la causa principal de SC y signos de isquemia y puede requerir revascularización) para ayudar en el diagnóstico (Ver Figura 5). Considere un monitor de catéter arterial para la PA y guíe el tratamiento. Más allá de un examen cardíaco y pulmonar centrado, el examen físico debe centrarse en la JVD y la perfusión de las extremidades. El examen RUSH y el cálculo de EF / CO / CI a través de las mediciones de LVOT VTI discutidas anteriormente son valiosos complementos de la evaluación. El uso de un enfoque integral para evaluar la CS permitirá comprender mejor esta enfermedad heterogénea y ayudará a guiar el manejo.
Conclusión del caso : En una evaluación adicional, la presión venosa yugular del paciente se eleva a 10 cmH20 y sus pies están frescos con llenado capilar tardío. El examen RUSH de cabecera muestra edema pulmonar difuso bilateral y una FE baja estimada.LVOT VTI se mide a solo 10 cm. El ECG muestra elevaciones del ST en las derivaciones precordiales. El lactato y la troponina están ligeramente elevados. El paciente se estabiliza con una prueba corta de dobutamina, furosemida intravenosa y CPAP con una mejoría moderada de los signos vitales y el estado respiratorio, y posteriormente se envía al laboratorio de cateterismo para una ICP de emergencia.
Puntos clave:
- El CS es causado principalmente por un infarto de miocardio agudo (~ 70%) y es el foco de la mayoría de los estudios, pero también se deben considerar otras causas (ver lista completa en la Figura 1).
- La mortalidad secundaria a CS sigue siendo alta (~ 60%), aunque la identificación e intervención tempranas mejoran la supervivencia.
- Realice un examen físico cuidadoso en busca de hipoperfusión y congestión. La JVP es un componente importante del examen físico para el diagnóstico de SC y se asocia con un aumento de la mortalidad (RR = 1,52).
- El examen RUSH es tanto sensible como específico (0,89 y 0,97, respectivamente) en el diagnóstico de CS. La ecografía de cabecera debe repetirse con frecuencia ya que la mayoría de los pacientes no se presentan inicialmente en el CS.
- El uso de LVOT VTI es un método simple y no invasivo para evaluar el GC con mediciones bajas asociadas con resultados adversos.
- En la Figura 5 se resume un enfoque sugerido para evaluar a los pacientes con sospecha de SC, centrándose en su patología y presentación heterogéneas.
Recursos FOAMed:
- EM en 5 : Choque
- emDocs: Choque cardiogénico
- emDocs: Manejo de la insuficiencia cardíaca en el servicio de urgencias – Perlas y obstáculos
- emDocs: Protocolo RUSH («Ultrasonido rápido para choque»)
- emDocs: El paciente con DE hipotenso: un enfoque sistemático secuencial
- Primeros 10 ME: hipotensión indiferenciada
